
【题目】以化工厂铬渣(含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠的工艺流程如下:

已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
(1)根据下图信息,操作B的最佳方法是_______________________。

(2)“母液”中主要含有的离子为_________________。
(3)酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为______________。
(4)酸化、还原操作时,酸C和Na2SO3溶液是____________(填“先后加入”或“混合后加入”),理由是___________________________。
(5)若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为____________。
(6)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的____________极相连,其电极反应式为____________。透过交换膜的离子为____________,该离子移动的方向为____________ (填“a→b”或“b→a”)。
Cr2O72-+H2O设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极与电源的____________极相连,其电极反应式为____________。透过交换膜的离子为____________,该离子移动的方向为____________ (填“a→b”或“b→a”)。

【答案】 蒸发结晶、趁热过滤 Na+、SO42-、Cr2O72- 3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O 先后加入 避免Na2SO3与H2SO4直接反应而降低还原效率 0.01mol/L 正极 4OH--4e-=O2↑+2H2O(或2H2O-4e-=O2↑+4H+) Na+ b→a
【解析】(1)本实验的目的要制备硫酸钠晶体,根据图示信息可知,硫酸钠在温度高时,溶解度降低,因此可以采用蒸发结晶、趁热过滤操作方法得到晶体;正确答案:蒸发结晶、趁热过滤。
(2)根据流程看出,调节溶液的pH约为3.6时,铁离子已经沉淀,过滤后滤液中剩余的主要离子有Na+、SO42-、Cr2O72- ;正确答案:Na+、SO42-、Cr2O72-。
(3)酸化后的Cr2O72-可被SO32-还原为Cr3+,SO32-被氧化为SO42-,该反应的离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;正确答案:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O。
(4)Na2SO3能够与硫酸反应生成二氧化硫,导致亚硫酸酸根浓度减小,还原效率降低;所以还原操作时,酸C和Na2SO3溶液是先后加入,避免Na2SO3与H2SO4直接反应;正确答案:先后加入;免Na2SO3与H2SO4直接反应而降低还原效率。
(5)Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时,pH=5,所以Ksp=c3(OH-)×c(Cr3+)=(10-9)3×1.0×10-5=10-32;若pH=4.0时,c(H+)=10-4mol/L c(OH-)=10-10mol/L,根据Ksp=c3(OH-)×c(Cr3+)=(10-10)3×c(Cr3+)=10-32,c(Cr3+)= 0.01mol/L,因此溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为0.01mol/L ;正确答案:0.01mol/L。
(6)根据2CrO42-+2H+![]() Cr2O72-+H2O反应可知:右侧b内溶液中氢离子浓度增大,平衡右移,说明溶液中氢氧根离子失电子变为氧气,发生氧化反应,该极为阳极,与电源的正极相连接,因此图中右侧电极与电源的正极相连;其电极反应式为4OH--4e-=O2↑+2H2O;根据图示可知透过交换膜的离子为Na+;钠离子向阴极移动,即向电解池的左侧a方向移动,即b→a;正确答案: 正极;4OH--4e-=O2↑+2H2O(或2H2O-4e-=O2↑+4H+);Na+;b→a。
Cr2O72-+H2O反应可知:右侧b内溶液中氢离子浓度增大,平衡右移,说明溶液中氢氧根离子失电子变为氧气,发生氧化反应,该极为阳极,与电源的正极相连接,因此图中右侧电极与电源的正极相连;其电极反应式为4OH--4e-=O2↑+2H2O;根据图示可知透过交换膜的离子为Na+;钠离子向阴极移动,即向电解池的左侧a方向移动,即b→a;正确答案: 正极;4OH--4e-=O2↑+2H2O(或2H2O-4e-=O2↑+4H+);Na+;b→a。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示:
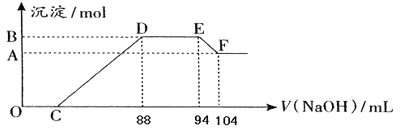
(1)B与A的差值为________mol。
(2)C点对应的溶液体积为________mL。
(3)原硝酸溶液中含硝酸的物质的量为________mol。
(4)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为_______________。
(5)写出铝与该浓度硝酸反应的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 100gKHCO3晶体中含有的离子数为3NA
B. 一定条件下,将71gCl2和足量的PCl3混合充分反应,可得到NA个PCl5分子
C. 3molFe在纯氧中完全燃烧转移的电子数为8NA
D. 标准状况下,22.4L正戊烷中含有共价键的数目为16NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁装入下图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是( )

A. 分解的气体产物中有SO3、SO2,应该先检验SO3
B. 装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成
C. 装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D. 装置d之后需要增加尾气处理装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同物质之间的关系,下列说法正确的是

A. 若a表示化合物,b表示脂质,c表示固醇,则甲可以表示细胞中的物质
B. 若a表示核酸,b表示RNA,则c可以表示A、C、G、T四种含氮碱基
C. 若a表示糖类,b表示二糖,则c可以表示纤维素
D. 若a表示蛋白质,则b可表示酶,c可以表示胃蛋白酶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说明正确的是( )
A. 测定次氯酸钠溶液pH时,用玻璃棒蘸取溶液,点在干燥pH试纸上
B. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
C. 向容量瓶转移液体时,引流用的玻璃棒下端靠在容量瓶瓶颈刻度线以上
D. 证明亚硫酸钠溶液中存在SO32-+H2O![]() HSO3-+OH-平衡时,先滴入酚酞溶液变红,再加入氯水后红色褪去
HSO3-+OH-平衡时,先滴入酚酞溶液变红,再加入氯水后红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2 的捕集利用技术成为研究的重点。
(1)目前国际空间站处理CO2的一个重要方法是将CO2 还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强P(B)代替该气体物质的量的浓度c(B),则该反应的Kp=_______________(用表达式表示)。
(2)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。

①X是电源的_________极。
②阳极的反应式是_____________________________________。
(3)以CO2为原料制取碳(C)的太阳能工艺如图所示。

①过程1中发生反应的化学方程式为_________________________________。
②过程2中每生成1molFe3O4转移电子的物质的量为_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com