
【题目】Ag/A12O3催化剂在工业上具有广泛用途.废银催化剂中银的回收既可节约资源,又有较好的经济效益.回收银的简化流程如图所示(部分条件和试剂略): 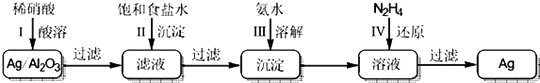
请回答下列问题:
(1)第Ⅰ步中,载体A12O3不与稀硝酸反应.Ag和稀硝酸反应产生的气体是
(2)第Ⅱ步中,饱和食盐水由工业食盐水提纯而得.除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,正确的操作顺序是(填字母编号).
a.加入稍过量的NaOH溶液 b.加入稍过量的BaC12溶液 c.过滤
d.加入稍过量的Na2CO3溶液 e.加入适量盐酸
(3)第III步中,加入氨水使沉淀溶解的离子方程式是
(4)N2H4具有还原性,氧化产物为N2 . 第IV步反应的产物除Ag和N2外,还有的物质是(填化学式).
(5)N2H4可用作火箭推进剂.已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣116kJ/mol
N2(g)+O2(g)=2NO(g)△H=+183kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是 .
(6)Ag可制备银锌纽扣电池正极材料Ag2O2 , 碱性条件下该电池的正极反应式是 .
(7)若上述流程中第Ⅰ、Ⅱ、Ⅲ步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是kg.
【答案】
(1)NO
(2)abdce
(3)AgCl+2NH3?H2O=[Ag(NH3)2]++Cl﹣+2H2O
(4)NH4Cl、NH3
(5)2N2H4(1)+2NO2(g)=3N2(g)+4H2O(g)△H=﹣1135 kJ/mol
(6)Ag2O2+2H2O+4e﹣=2Ag+4OH﹣
(7)5.4×l0﹣4ab
【解析】解:在Ag/A12O3中加稀硝酸生成硝酸银,过滤,在滤液中加饱和食盐水,生成氯化银沉淀,过滤,滤渣为AgCl,把AgCl溶解在氨水中,然后加N2H4还原得到Ag;(1)第Ⅰ步中,载体A12O3不与稀硝酸反应,Ag与稀硝酸反应生成硝酸银和NO;所以答案是:NO;(2)除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,先加碳酸钠除去CaC12、再加氯化钡除去Na2SO4和多余的碳酸钠,NaOH用于除去MgC12可前可后,只有顺序在过滤操作之前即可,过滤后,然后加盐酸,所以操作顺序为:abdce或badce或bdace;所以答案是:abdce或badce或bdace;(3)AgCl溶于氨水生成银氨络离子,其反应的离子方程式为:AgCl+2NH3H2O=[Ag(NH3)2]++Cl﹣+2H2O;
所以答案是:AgCl+2NH3H2O=[Ag(NH3)2]++Cl﹣+2H2O;(4)银氨溶液中加N2H4 , N2H4具有还原性,氧化产物为N2 , 还原产物为Ag,反应方程式为:4[Ag(NH3)2]Cl+N2H4=4Ag+N2+4NH4Cl+4NH3 , 则产物除Ag和N2外,还有的物质是NH4Cl、NH3;
所以答案是:NH4Cl、NH3;(5)N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJ/mol①
2NO(g)+O2(g)=2NO2(g)△H=﹣116kJ/mol②
N2(g)+O2(g)=2NO(g)△H=+183kJ/mol③
根据盖斯定律:①×2﹣②﹣③得:2N2H4(1)+2NO2(g)=3N2(g)+4H2O(g)△H=﹣1135 kJ/mol;
所以答案是:2N2H4(1)+2NO2(g)=3N2(g)+4H2O(g)△H=﹣1135 kJ/mol;(6)碱性条件下,Ag2O2在正极上得电子生成Ag和氢氧根离子,其电极反应式为Ag2O2+2H2O+4e﹣=2Ag+4OH﹣;
所以答案是:Ag2O2+2H2O+4e﹣=2Ag+4OH﹣;(7)第Ⅰ、Ⅱ、Ⅲ步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,则Ag的质量为a×b%×90%×90%×90%=7.29ab×10﹣4kg,已知4[Ag(NH3)2]Cl+N2H4=4Ag+N2+4NH4Cl+4NH3 ,
则 4Ag~~~~~~~~N2H4
4×108 32
7.29ab×10﹣4kg m(N2H4)
所以m(N2H4)= ![]() =5.4×l0﹣4abkg;
=5.4×l0﹣4abkg;
所以答案是:5.4×l0﹣4ab.


科目:高中化学 来源: 题型:
【题目】有铁和锌的混合物共9.3g,与500mL盐酸恰好完全反应,在标准状况下共收集到3.36LH2 , 求:
(1)铁的质量是g;
(2)反应前,盐酸的物质的量浓度为mol/L;
(3)写出锌与盐酸反应的离子方程式并用双线桥表示电子转移.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成导电高分子材料PPV的反应: ![]()
下列说法正确的是( )
A.合成PPV的反应为加聚反应
B.PPV与聚苯乙烯具有相同的重复结构单元
C.![]() 和苯乙烯互为同系物
和苯乙烯互为同系物
D.通过质谱法测定PPV的平均相对分子质量,可得其聚合度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能说明氯元素的非金属性比硫元素强的是( )
A. 氯气与氢硫酸能发生置换反应B. 盐酸是强酸,氢硫酸是弱酸
C. 高氯酸的酸性比硫酸强D. 受热时,氯化氢比硫化氢稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z是短周期元素,原子序数依次增大.Q的基态原子最外层s轨道和p轨道电子数相等;R的一种氢化物是常见的碱性气体;X在同周期元素中,其氧化物的水化物是最强的碱;Y的一种氧化物能使品红溶液褪色;Z的最高价氧化物的水化物是最强的酸.
请回答下列问题:
(1)R位于元素周期表中第周期,第族.
(2)Q形成的最高价氧化物分子是(填“极性”或“非极性”)分子,中心原子的杂化轨道类型是 .
(3)Y、Z的氢化物中,稳定性较强的是(填氢化物的化学式).
(4)X单质的晶体的晶胞示意图是(填字母编号). 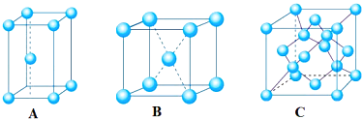
(5)Y的最高价含氧酸根Y2O82﹣中,Y和Y之间有一过氧键,该酸根具有极强的氧化性,在Ag+的催化下,能将酸性介质中的Mn2+氧化成MnO4﹣ , 而Y的价态不变,该反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一盛满二氧化氮和氧气(体积比为1:1)的试管倒立在水槽中,相当长一段时间后,试管中剩余气体的体积占试管容积的
A. 1/4B. 1/3C. 2/3D. 3/8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气和CO2按体积比5∶1混合,将混合气体与足量的红热焦炭充分反应,设空气中N2和O2的体积比为4∶1,不计其他成分,且体积均在同温、同压下设定,则反应后的气体中CO的体积分数是
A. 50% B. 29% C. 43% D. 100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有200 mL 1.5 molL﹣1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为甲:乙=2:3,则加入铝粉质量为( )
A.6.75 g
B.4.05g
C.2.70 g
D.1.80 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业中会产生大量含铬废水,直接排放会产生污染.
(1)工业上处理酸性含Cr2O72﹣废水的方法如下:
①SO2还原法:向1000L含0.002molL﹣1 Cr2O72﹣的酸性废水中通入SO2使Cr2O72﹣全部转化为Cr3+ , 至少需要通入L SO2(标准状况)
②铁屑还原法:向含Cr2O72﹣的酸性废水中加入废铁屑,加热充分反应后,加入熟石灰调节溶液的pH,使Cr3+完全沉淀.
已知25℃时,Ksp[Cr(OH)3]=6.3×10﹣31 . 欲使溶液中残余Cr3+的物质的量浓度为6.3×10﹣7 molL﹣1 , 应调节溶液的pH= .
(2)铬元素总浓度的测定:准确移取20.00mL含Cr2O72﹣和Cr3+的酸性废水,向其中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72﹣ , 煮沸除去过量(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.03molL﹣1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL.
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会 .
②计算废水中铬元素总浓度(单位:mgL﹣1 , 写出计算过程)
已知测定过程中发生的反应如下:
①2Cr3++3S2O82﹣+7H2O=Cr2O72﹣+6SO42﹣+14H+
②Cr2O72﹣+6I﹣+14H+=2Cr3++3I2+7H2O
③I2+2S2O32﹣=2I﹣+S4O62﹣ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com