
”¾ĢāÄæ”æŌŚt”ćCŹ±£¬AgBrŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼ĖłŹ¾”£ÓÖÖŖt”ćCŹ±AgClµÄKsp=4”Į10-10£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ( )
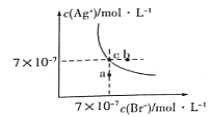
A£®Ķ¼ÖŠaµć¶ŌÓ¦µÄŹĒAgBrµÄ²»±„ŗĶČÜŅŗ
B£®ŌŚt ”ćCŹ±£¬AgBrµÄKspĪŖ 4.9”Į10-13
C£®ŌŚAgBr±„ŗĶČÜŅŗÖŠ¼ÓČėNaBr¹ĢĢ壬æÉŹ¹ČÜŅŗÓÉcµćµ½bµć
D£®ŌŚt ”ćCŹ±£¬AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)µÄĘ½ŗā³£ŹżK”Ö816
AgBr(s)+C1- (aq)µÄĘ½ŗā³£ŹżK”Ö816
”¾“š°ø”æC
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗA£®øł¾ŻĶ¼ĻóæÉÖŖ£¬ŌŚaµćŹ±Qc=c(Ag+)c(Br-)£¼Ksp£¬ĖłŅŌaµćĪŖAgBrµÄ²»±„ŗĶČÜŅŗ£¬¹ŹAÕżČ·£»B£®½įŗĻĶ¼ÖŠcµćµÄc(Ag+)ŗĶc(Br-)æÉÖŖ£ŗøĆĪĀ¶ČĻĀAgBrµÄKsp=7”Į10-7”Į7”Į10-7=4.9”Į10-13£¬¹ŹBÕżČ·£»C£®ŌŚAgBr±„ŗĶČÜŅŗÖŠ¼ÓČėNaBr¹ĢĢåŗó£¬c(Br-)Ōö“ó£¬ČܽāĘ½ŗāÄęĻņŅĘ¶Æ£¬c(Ag+)¼õŠ”£¬¹ŹC“ķĪó£»D£®·“Ó¦AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)µÄĘ½ŗā³£ŹżĪŖ£ŗK=![]() =
=![]() ”Ö816£¬¹ŹDÕżČ·£»¹ŹŃ”C”£
”Ö816£¬¹ŹDÕżČ·£»¹ŹŃ”C”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼A”¢B”¢CČżøöÉÕ±ÖŠ·Ö±šŹ¢ÓŠĻąĶ¬ĪļÖŹµÄĮæÅØ¶ČµÄĻ”ĮņĖį”£
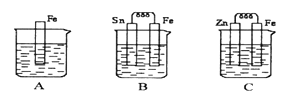
£Ø1£©AÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________£¬BÖŠSn¼«ø½½ü»į³öĻÖµÄĻÖĻó_________________£¬CÖŠZnʬÉĻµÄµÄµē¼«·“Ó¦Ź½ĪŖ________£¬·¢Éś__________·“Ó¦£ØĢī”°Ńõ»Æ·“Ó¦”±»ņ”°»¹Ō·“Ó¦”±£©”£
£Ø2£©A”¢B”¢CÖŠĢśČܽāµÄĖŁĀŹÓÉæģµ½ĀżµÄĖ³ŠņŹĒ_________________ ”£
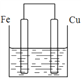
£Ø3£©Čō½«ÖŹĮæĻąµČµÄĢśĘ¬ŗĶĶʬÓƵ¼ĻßĻąĮ¬½žČėĮņĖįĶČÜŅŗÖŠ¹¹³ÉŌµē³Ų£¬ČēĶ¼£¬µē×ÓÓÉ_________¼«Į÷³ö£ØĢīŌŖĖŲ·ūŗÅ£©£¬Ņ»¶ĪŹ±¼äŗó£¬Į½µē¼«ÖŹĮæĻą²ī1.2g£¬Ōņµ¼ĻßÖŠĶعżµÄµē×ÓµÄĪļÖŹµÄĮæĪŖ______mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆHNO3ŗĶHFµÄ»ģĖį“¦Ąķij½šŹōŗ󣬲śÉśµÄĖįĻ“·ĻŅŗÖŠŗ¬ÓŠFe3+”¢Ni2+”¢NO3-”¢F-ŗĶCr2O72-µČ”£ĻĀĶ¼ŹĒ×ŪŗĻĄūÓĆøĆĖįĻ“·ĻŅŗµÄ¹¤ŅÕĮ÷³Ģ£ŗ
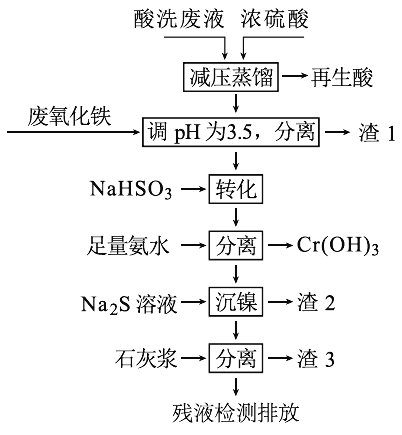
ŅŃÖŖ£ŗ
½šŹōĄė×ÓæŖŹ¼³ĮµķŗĶ³ĮµķĶźČ«Ź±µÄpH£ŗ
Fe3+ | Ni2+ | Cr3+ | |
æŖŹ¼³Įµķ | 1.5 | 6.7 | 4.0 |
³ĮµķĶźČ« | 3.4 | 9.5 | 6.9 |
¢ŚNi2+Óė×ćĮæ°±Ė®µÄ·“Ó¦ĪŖ£ŗNi2+£«6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
£Ø1£©ŌŁÉśĖįÖŠŗ¬ÓŠHNO3,²ÉČ”¼õŃ¹ÕōĮóµÄÄæµÄĪŖ____________£¬
£Ø2£©ĀĖŌü£±µÄÖ÷ŅŖ³É·ŻĪŖ£ŗ____________”£
£Ø3£©ĒėŠ“³ö”°×Ŗ»Æ”±Ź±NaHSO3ÓėCr2O72-·¢Éś·“Ó¦µÄŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±Č£ŗ________”£
£Ø4£©ŅŃÖŖ[Ni(NH3)6]2+ĪŖÄѵēĄėµÄĀēŗĻĄė×Ó£¬Ōņ”°³ĮÄų”±µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ____________”£
£Ø5£©ĀĖŌü3µÄÖ÷ŅŖ³É·ÖĪŖCaSO4”¢Ca(OH)2ŗĶ_____”£
£Ø6£©¾¼ģ²ā£¬×īŗóµÄ²ŠŅŗÖŠc(Ca2+)£½0.001 molL-1£¬Ōņ²ŠŅŗÖŠF£ÅضČĪŖ____mgL-1£¬______£ØĢī”°·ūŗĻ”±»ņ”°²»·ūŗĻ”±£©Åŷűź×¼[ŅŃÖŖKsp(CaF2)=4”Į10-11£¬¹ś¼ŅÅŷűź×¼ŅŖĒ󷜥ė×ÓÅØ¶ČŠ”ÓŚ10 mgL-1]”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĖ®ČÜŅŗ£¬æÉÄÜŗ¬ÓŠŅŌĻĀĄė×ÓÖŠµÄČōøÉÖÖ£ŗK£«”¢NH4+”¢Cl£”¢Mg2£«”¢Ba2£«”¢CO32£”¢SO42££¬ĻÖČ”Į½·Ż100 mLČÜŅŗ½ųŠŠČēĻĀŹµŃé£ŗ
¢ŁµŚŅ»·Ż¼Ó×ćĮæNaOHČÜŅŗ¼ÓČČŗó£¬ŹÕ¼Æµ½ĘųĢå0.05 mol£»
¢ŚµŚ¶ž·Ż¼Ó×ćĮæBaCl2ČÜŅŗŗ󣬵ĆøÉŌļ³Įµķ4.3 g£¬¾×ćĮæŃĪĖįĻ“µÓ”¢øÉŌļŗ󣬳ĮµķÖŹĮæĪŖ2.33 g”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. K£«Ņ»¶Ø“ęŌŚ
B. ČÜŅŗÖŠc(Cl£)æÉÄÜĪŖ0.2 mol/L
C. Cl£æÉÄÜ“ęŌŚ
D. Ba2£«Ņ»¶Ø²»“ęŌŚ£¬Mg2£«æÉÄÜ“ęŌŚ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”¾Č«¹śŠ£¼¶ĮŖæ¼.2017½ģÕć½Ź”»üŃōĮŖŅźŃ§Š£øßČż3ŌĀŃ”æ¼”æ³£ĪĀĻĀ£¬0.2 moI”¤L-lµÄNa2CO3ČÜŅŗÓė0.2 moI”¤L-lµÄŃĪĖįµČĢå»ż»ģŗĻŗó£¬ĖłµĆČÜŅŗÖŠ²æ·ÖĪ¢Į£×é·ÖÓėÅØ¶ČµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬X”¢Y”¢Z¾ł±ķŹ¾ŗ¬Ģ¼Ī¢Į££¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
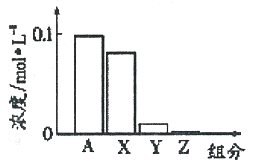
A. A“ś±ķNa+ÅضČ
B. øĆČÜŅŗÖŠc(OH-)>c(Y)
C. ĻņøĆČÜŅŗÖŠ¼ÓĖ®Ļ”ŹĶ£¬ĖłÓŠĄė×ÓÅØ¶Č¾ł¼õŠ”
D. øĆ»ģŗĻČÜŅŗÖŠ£ŗc(X)+c(Y)+c(Z)=2c(Na+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”¾Č«¹śŹ”¼¶ĮŖæ¼.¶«±±ČżŹ”ĖÄŹŠ½ĢŃŠĮŖŗĻĢå2017½ģøßČżøßæ¼Ä£ÄāŹŌĢā£ØŅ»£©”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. KAl(SO4)2ČÜŅŗÖŠ c(K+)= 2c(SO42-)
B. ĻņNaHCO3ČÜŅŗÖŠ¼ÓČėÉŁĮæ Ba(OH)2¹ĢĢ壬c(CO32-)Ōö“ó
C. ŗ¬ÓŠAgClŗĶAgBr¹ĢĢåµÄŠü×ĒŅŗÖŠ£¬C(Ag+)>c(Cl-) =c(Br-)
D. ³£ĪĀĻĀ£¬Ļņŗ¬0.1molCH3COOHµÄČÜŅŗÖŠ¼ÓČėamolNaOH¹ĢĢ壬·“Ó¦ŗóČÜŅŗÖŠc(CH3COOH) =c(CH3COO-)£¬ŌņČÜŅŗĻŌ¼īŠŌ”££ØŅŃÖŖ“×ĖįKa =1.75”Į10-5 )
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠø÷×é»ģŗĻĪļ£¬²»ÄÜÓĆ·ÖŅŗĀ©¶··ÖæŖµÄŹĒ£ŗ¢ŁĖÄĀČ»ÆĢ¼”¢Ė® ¢ŚŅŅ“¼”¢øŹÓĶ ¢Ū ŅŅ“¼”¢Ė® ¢Ü±½”¢Ė® ¢Ż¼ŗĶ锢Ė® ¢Ž»·¼ŗĶ锢±½ ¢ßäå±½”¢Ė®
A£®¢Ś¢Ū¢Ž B£®¢Ł¢Ś¢Ū C£®¢Ł¢Ü¢Ż¢ß D£®¢Ü¢Ż¢Ž
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ(2014”¤°²»ÕĄķ×Ū£¬11£¬6·Ö)ŹŅĪĀĻĀ£¬ĻĀĮŠ¹ŲĻµÕżČ·µÄŹĒ( )
A£®Na2SČÜŅŗ£ŗc(Na£«)>c(HS£)>c(OH£)>c(H2S)
B£®Na2C2O4ČÜŅŗ£ŗc(OH£)£½c(H£«)£«c(HC2O![]() )£«2c(H2C2O4)
)£«2c(H2C2O4)
C£®Na2CO3ČÜŅŗ£ŗc(Na£«)£«c(H£«)£½2c(CO![]() )£«c(OH£)
)£«c(OH£)
D£®CH3COONaŗĶCaCl2»ģŗĻČÜŅŗ£ŗc(Na£«)£«c(Ca2£«)£½c(CH3COO£)£«c(CH3COOH)£«2c(Cl£)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×“¼ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬Ņ²ŹĒŅ»ÖÖÓÅÖŹµÄČ¼ĮĻ”£
¢ń.¼×“¼ĶŃĒāÖĘČ”¼×Č©µÄŌĄķĪŖCH3OH(g)![]() HCHO(g) +H2(g)”£Ä³æĘŃŠŠ”×éŌŚ2 LĆܱÕČŻĘ÷ÖŠ³äČė1 mol CH3OH£¬¶ŌøĆ·“Ó¦½ųŠŠĮĖŅ»ĻµĮŠµÄŃŠ¾æ£¬µĆµ½¼×“¼µÄĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶ČµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£
HCHO(g) +H2(g)”£Ä³æĘŃŠŠ”×éŌŚ2 LĆܱÕČŻĘ÷ÖŠ³äČė1 mol CH3OH£¬¶ŌøĆ·“Ó¦½ųŠŠĮĖŅ»ĻµĮŠµÄŃŠ¾æ£¬µĆµ½¼×“¼µÄĘ½ŗā×Ŗ»ÆĀŹĖęĪĀ¶ČµÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£
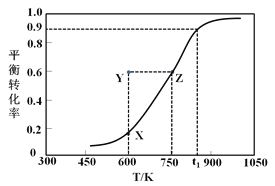
£Ø1£©ĻĀĮŠŃ”ĻīÖŠ£¬ÄÜĖµĆ÷øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ__________£»
a£®v(CH3OH) =v(HCHO) b£®H2µÄĢå»ż·ÖŹż²»ŌŁ±ä»Æ
c£®¼×Č©µÄÖŹĮæ·ÖŹż²»ŌŁøıä d£®»ģŗĻĘųĢåĆÜ¶Č²»±ä
£Ø2£©ŌŚt1Ź±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖK=________________£¬“ĖĪĀ¶ČĻĀ£¬“Ó·“Ó¦æŖŹ¼µ½Ę½ŗāĖł¾¹żµÄŹ±¼äĪŖ5 s£¬Ōņv(HCHO)ĪŖ_______mol/(L”¤min)”£Ļņ“ĖČŻĘ÷ÖŠŌŁĶØČė1.1 mol CH3OHŗĶ1.1 mol H2£¬ŌņĘ½ŗāĻņ_________£ØĢī”°Õż·“Ó¦”±»ņ”°Äę·“Ó¦”±£©·½ĻņŅĘ¶Æ£»
£Ø3£©600 KŹ±£¬Yµć¼×“¼µÄv(Õż)_______v(Äę) (Ģī”°>”±”¢”°<”±»ņ”°=”±)£¬ĄķÓÉŹĒ_____________________£»
¢ņ.ŅŃÖŖ£ŗCH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ¦¤H1=£a kJ/mol£»
2Cu(s)+O2(g)=2CuO(s) ¦¤H2=£b kJ/mol£»
£Ø4£©ŌņŌŚĶ×÷“߻ƼĮŹ±£ŗ2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ¦¤H3=______kJ/mol£ØÓĆŗ¬a£¬bµÄ“śŹżŹ½±ķŹ¾£©£»
¢ó.ČēĶ¼ĖłŹ¾ŹĒŅŌNaOHČÜŅŗĪŖµē½āÖŹČÜŅŗµÄ¼×“¼Č¼ĮĻµē³Ų£ŗ

£Ø5£©a¼«µē¼«·“Ó¦Ź½ĪŖ__________________________£¬ČōøōĤĪŖŅõĄė×Ó½»»»Ä¤£¬Ōņµē³Ų¹¤×÷Ņ»¶Īŗ󣬵ē³Ųøŗ¼«ĒųČÜŅŗÖŠn(OH£)_____£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com