
 X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、M、N、Q为元素周期表前四周期的六种主族元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.请回答下列问题: .
.分析 X、Y、Z、M、N、Q为元素周期表前四周期的六种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素,据此解答.
解答 解:X、Y、Z、M、N、Q为元素周期表前四周期的六种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素,
(1)X为S元素,元素在周期表中的位置是:第三周期ⅥA族,外围电子排布为3s23p4,最后1个电子填充p能级,属于p区元素,它的外围电子的电子排布图为 ,
,
故答案为:第三周期ⅥA族;p; ;
;
(2)SO2分子中S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,S原子含有1对孤电子对,故其立体结构是V形,CO2分子结构式为O=C=O,C原子呈2个σ键、没有孤电子对,C的杂化轨道类型为sp杂化,SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大,
故答案为:V形;O=C=O;sp;SO2;SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
(3)含有K元素的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量,
故答案为:紫;电子由较高能级跃迁到较低能级时,以光的形式释放能量;
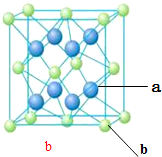
(4)由晶胞晶胞可知,a离子周围连接4个b离子,则a离子配位数为4,
故答案为:4.
点评 本题是对物质结构的考查,涉及核外电子的排布、跃迁、分子结构与性质、晶胞结构等,难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | HClO═H++ClO- | ||
| C. | NaHCO3=Na++H++CO32- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 0.1mol•L-1pH为4的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 0.1 mol•L-1 Na2S溶液中:2c(Na+)═c(S2-)+c(HS-)+c(H2S) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)═c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | NaHCO3和过量NaOH溶液相混合:HCO3-+OH-═CO32-+H2O | |
| C. | NaHSO4溶液中滴加NaHCO3溶液:H++HCO3-═H2O+CO2↑ | |
| D. | 用NaOH吸收过量的CO2:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 洗气瓶中产生的沉淀是碳酸钡 | |
| B. | 洗气瓶中产生的沉淀是硫酸钡 | |
| C. | 在Z导管出来的气体中无二氧化碳 | |
| D. | 反应一段时间后洗气瓶中溶液的酸性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol
已知:①CO(g)+H2O(g)?H2(g)+CO2(g);△H=-41.2kJ/mol| A. | △H3=+206kJ/mol | |
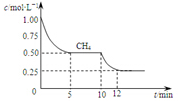
| B. | 反应③进行到10min时,改变的外界条件可能是升高温度 | |
| C. | 反应③进行过程中,0~5min这段时间共吸收的热量为103.05kJ | |
| D. | 当反应③平衡后,向容器中通入CH4,平衡向正反应方向移动,CH4的转化率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 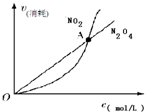 表示在恒容密闭容器中,恒温条件下发生的可逆反应2NO2(g)?N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| B. | 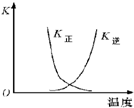 曲线表示反应2A(g)+B(g)?2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 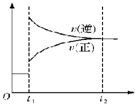 表示对反应2X(g)+Y(g)?Z(s)+3W(g)△H<0 在t1时刻增大压强 | |
| D. | 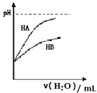 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com