

| A. | 用图1示装置制备Cl2 | |
| B. | 将混合气体通过装有NaOH溶液的洗气瓶除去Cl2中混有的HCl | |
| C. | 用图2示装置分离CH3COOC2H5与饱和Na2CO3溶液 | |
| D. | 称取1.06 g Na2CO3固体,置于100 mL容量瓶中,加水稀释,配制0.10 mol•L-1的Na2CO3溶液 |
分析 A.浓盐酸与二氧化锰加热制备氯气;
B.二者均与NaOH反应;
C.CH3COOC2H5与饱和Na2CO3溶液分层;
D.不能在容量瓶中稀释.
解答 解:A.浓盐酸与二氧化锰加热制备氯气,图中缺少酒精灯加热,故A错误;
B.二者均与NaOH反应,不能除杂,应选饱和食盐水,故B错误;
C.CH3COOC2H5与饱和Na2CO3溶液分层,则利用图中分液漏斗可分离,故C正确;
D.不能在容量瓶中稀释,应在烧杯中溶解、稀释、冷却后转移到容量瓶中,再定容,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质及实验装置的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、N${O}_{3}^{-}$、Cl- | B. | Na+、N${H}_{4}^{+}$、S${O}_{4}^{2-}$、Cl- | ||
| C. | Na+、H+、C${O}_{3}^{2-}$、N${O}_{3}^{-}$ | D. | Na+、K+、Mn${O}_{4}^{-}$、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
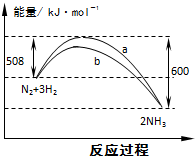
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1molN2和3molH2充分反应后,放出92kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 加入正催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮原子的结构示意图: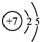 | |
| C. | 氨分子的电子式: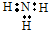 | |
| D. | 对硝基甲苯的结构简式:NO2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:0.1 mol•L-1 FeCl3溶液与0.3 mol•L-1 NaOH溶液等体积混合 | |
| B. | 验证溴原子:取C2H5Br少许与NaOH溶液共热,冷却后滴加AgNO3溶液 | |
| C. | 检验Fe2+:取少量待测液,向其中加入适量新制氯水,再滴加KSCN溶液 | |
| D. | 比较AgCl和AgI的溶解度:向2 mL 0.1 mol•L-1 NaCl溶液中滴加数滴同浓度AgNO3溶液,然后再滴入KI溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
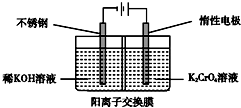
| A. | 在阴极室,发生的电极反应为2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程中总反应的化学方程式为4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com