
| 1000ρw |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |
| 1.00mol/L×0.1L |
| 18.4mol/L |


科目:高中化学 来源: 题型:
| A、电极只能由两种不同的金属构成 |
| B、负极发生的电极反应是还原反应 |
| C、工作时其正极不断产生电子并经外电路流向负极 |
| D、能将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中生成了22.4L CO |
| B、反应中有12g碳被还原 |
| C、有0.5mol SiO2参加反应 |
| D、反应中有0.5×6.02×1023个电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
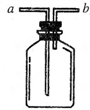 (1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是
(1)现有人图所示装置,为实现下列实验目的,其中应以a端作为入口的是查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ |
| 0.1mol?L-1 CH3COOH溶液 | 0.01mol?L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 |
0.1mol?L-1 NaOH溶液 |
0.1mol?L-1 氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
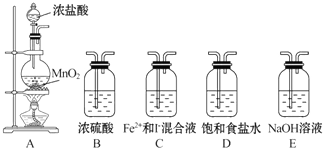
| 实验步骤 | 预期现象和结论 |
| 取少量反应后的混合溶液分置于A、B两试管中: 往A中滴加 往B中滴加 |
①A: ②B: 则假设1成立. ③A: ④B: 则假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
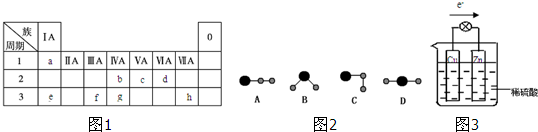
查看答案和解析>>
科目:高中化学 来源: 题型:
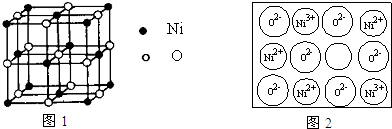
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com