
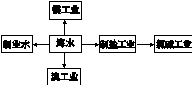
| A.海水制淡水主要有蒸馏法、电渗析法、离子交换法等 |
| B.海水制盐、发展氯碱工业都是发生物理变化 |
| C.海水提溴过程中先通入Cl2将溴离子氧化为溴单质 |
| D.工业上用电解熔融MgCl2的方法制取金属镁 |
科目:高中化学 来源:不详 题型:单选题
| A.Si→SiO2→H2SiO3→Na2SiO3 |
| B.Al→Al2O3→Al(OH)3→NaAlO2 |
| C.N2→NH3→NO→NO2→HNO3→NO2 |
| D.S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③⑤②④ | B.②①③④⑤ | C.②④①③⑤ | D.③①②⑤④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
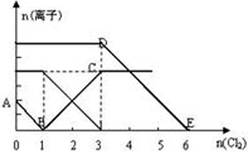
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
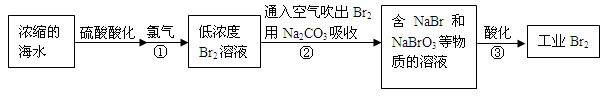
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体 HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体 |
| B.在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4 |
| C.用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 |
| D.亚硫酸钠具有较强的还原性,检验亚硫酸钠试样是否变质: |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
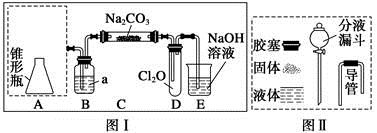
| 实验步骤 | 现象和结论 |
| 步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中。 | |
| 步骤二:向a试管中滴加BaCl2溶液,静置。 | 无明显现象,证明固体中不含Na2CO3。 |
| 步骤三: | |
| 步骤四: | 则证明固体中含有NaCl。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
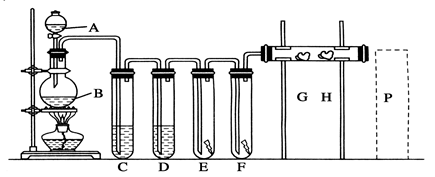
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 |
| B.Ⅱ图中:量筒中发生了加成反应 |
| C.Ⅲ图中:生成蓝色的烟 |
| D.Ⅳ图中:湿润的有色布条能褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com