
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 45.8 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 452 | 488 | 614 |
分析 (1)该电池的正极发生还原反应,MnO2被还原生成MnOOH;负极锌被氧化生成Zn2+,以此书写电池总反应式;
(2)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量为$\frac{150C}{96500C/mol}$,以此计算消耗锌的质量、物质的量;
(3)填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
解答 解:(1)该电池的正极发生还原反应,MnO2被还原生成MnOOH,电极方程式为MnO2+H++e-=MnOOH,负极锌被氧化生成Zn2+,电池总反应式为2MnO2+Zn+2H+=2MnOOH+Zn2+,
故答案为:MnO2+H++e-=MnOOH;2MnO2+Zn+2H+=2MnOOH+Zn2+;
(2)持电流强度为0.5A,电池工作五分钟,则电量为0.5A×300s=150C,转移电子的物质的量为$\frac{150C}{96500C/mol}$,则消耗Zn的质量为$\frac{150C}{96500C/mol}$×$\frac{1}{2}$×65g/mol=0.05g,
故答案为:0.05;
(3)滤液中主要有ZnCl2和NH4Cl,可通过加热浓缩、冷却结晶得到晶体,填充物含有碳粉、二氧化锰,且生成MnOOH等,在空气中加热时,碳粉、MnOOH可被氧化,分别生成二氧化碳和二氧化锰,故答案为:加热浓缩;冷却结晶;碳粉;MnOOH;空气中加热;碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)①SO2(g)+2CO(g)=2CO2(g)+$\frac{1}{x}$Sx(s)△H=akJ/mol;
②2COS(g)+SO2(g)=2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ/mol;
依据盖斯定律(-②+①×2)÷2得到:xCO(g)+Sx(s)=xCOS(g)△H=-0.5x(b-a)kJ/mol,
故答案为:xCO(g)+Sx(s)=xCOS(g)△H=-0.5x(b-a)kJ/mol.
点评 本题考查原电池知识以及物质的分离、提纯,侧重于原电池的工作原理、实验基本操作和注意问题以及盖斯定律的应用,题目难度中等,有利于培养学生良好的科学素养.


科目:高中化学 来源: 题型:解答题

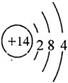 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅由实验②即可推断原混合溶液中一定存在Fe3+ | |
| B. | 要确定原混合溶液是否含有ClO- 至少需完成实验①②③ | |
| C. | 该溶液阳离子中一定存在Na+、Fe2+、Fe3+,一定不存在Al3+,无法确定是否含有K+ | |
| D. | 溶液中阴离子只有SO42-,且c(SO42-)大于2.75moL/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuS<Cu(OH)2<CuCO3 | B. | CuCO3<Cu(OH)2<CuS | C. | CuS<CuCO3<Cu(OH)2 | D. | Cu(OH)2<CuCO3<CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该气体一定是CO2 | |
| B. | 如果该气体无味,则该溶液中可能含CO32- | |
| C. | 如果该气体无味,则该溶液中可能含CO32-、HCO3-或者两者均有 | |
| D. | 如果该气体具有刺激性气味,则该溶液中可能含SO32-、HSO3-或者两者均有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | W | X | Y | Z | 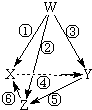 |
| A | N2 | NH3 | NO | NO2 | |
| B | Na | Na2O2 | NaOH | Na2CO3 | |
| C | Cu | CuSO4 | CuCl2 | Cu(OH)2 | |
| D | Al | Al2(SO4)3 | AlCl3 | NaAlO2 |
| A. | N2 NH3 NO NO2 | B. | Na Na2O2 NaOH Na2CO3 | ||
| C. | Cu CuSO4 CuCl2 Cu(OH)2 | D. | Al Al2(SO4)3 AlCl3 NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸氢钠溶液中加入足量烧碱溶液:HSO4-+OH-═SO42-+H2O | |
| C. | Ba(OH)2与H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com