
【题目】已知苯甲酸的酸性比碳酸强,苯酚的酸性比碳酸弱。则可以将
 转变为
转变为![]() 的方法是( )
的方法是( )
①与足量的NaOH溶液共热,再通入CO2②与稀硫酸共热后,加入足量的NaOH溶液③加热溶液,通入足量的CO2④与稀H2SO4共热后,加入足量的NaHCO3
A. ①②B. ①④C. ②③D. ②④
【答案】B
【解析】
因羧酸、酚羟基均与碱反应生成盐,则将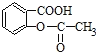 转变为
转变为![]() ,可选择与碱反应,然后利用碳酸酸性大于苯酚酸性,再通入二氧化碳即可;或先加稀硫酸水解后,利用苯酚酸性大于碳酸氢根离子的酸性,再与NaHCO3反应即可,以此来解答。
,可选择与碱反应,然后利用碳酸酸性大于苯酚酸性,再通入二氧化碳即可;或先加稀硫酸水解后,利用苯酚酸性大于碳酸氢根离子的酸性,再与NaHCO3反应即可,以此来解答。
①与足量的NaOH溶液共热,羧基与NaOH反应,酯基水解生成苯酚与NaOH反应生成苯酚钠,再通入CO2,与苯酚钠反应生成产物,①项正确;
②与稀硫酸共热后,加入足量的NaOH溶液,苯酚能与NaOH反应,则不能得到产物,②项错误;
③加热溶液,通入足量的CO2,因为苯甲酸的酸性比碳酸酸性强,所以不能得到羧酸钠,③项错误;
④与稀H2SO4共热后,酯基水解生成苯酚,加入足量的NaHCO3,羧基与NaHCO3反应得到产物,④项正确;
答案选B。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 足量MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA
B. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
D. 常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为10-11NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的两种方法。回答下列问题:
I.直接法

(1)气体X 为_______(填化学式)。
(2)写出“转化”步骤发生反应的离子方程式_________。
(3)滤液①中加入甲醇的作用是_____________。
(4)操作I 为__________。
II.电解法
电解法制取KH2PO4 的原理如图所示,一定条件下,还可得到NaClO3

(5)在_____室(填标号)可得到KH2PO4;写出产生ClO3-的电极反应式_____________。
III.纯度分析
测定产品纯度的反应原理为KH2PO4+NaOH=KNaHPO4+H2O
(6)取产品3.00 g,加入15 mL 蒸馏水溶解,加入指示剂,用0.5000 mol·L-1 NaOH 标准溶液滴定至终点,消耗40.00 mL,该产品的纯度为________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某同学进行CO2 与Na2O2 反应的探究实验,回答下列问题。
(1)用下图装置制备纯净的CO2

①丙装置的名称是__________,乙、丙装置中盛装的试剂分别是__________、_________。
②若CO2 中混有HCl,则HCl 与Na2O2 反应的化学方程式为_____________。
(2)按照下面的装置图进行实验(夹持装置略)。

①先组装仪器,然后_____________,再用注射器1 抽取100 mL 纯净的CO2,将其连接在K1 处,注射器2 的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1 的活塞,可观察到的现象是_________。
③实验过程中,需缓慢推入CO2,其目的是_____________,为达到相同目的,还可进行的操作是_____________。
(3)实验结束后,当注射器1 的活塞推到底时,测得注射器2 中气体体积为65 mL,则CO2的转化率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在实验室制取乙酸乙酯的主要步骤如下:
(1)在30mL的大试管 ①中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
(2)按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;

(3)待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层;
(4)分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液时,浓硫酸、乙醇、乙酸的滴加顺序是:_______。写出制取乙酸乙酯的化学方程式 ________。
(2)试管②中所加入的物质是:________,作用为_________。
A.中和乙酸和乙醇;
B.中和乙酸并吸收部分乙醇;
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出;
D.加速酯的生成,提高其产率。
(3)步骤(2)中需要小火均匀加热,温度不能太高,其主要理由是:_____(答一条即可)。
(4)分离出乙酸乙酯层所用到的主要仪器是________;为了干燥乙酸乙酯可选用的干燥剂为(填字母):_______。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用的原理(用化学方程式表示)及基本反应类型均正确的是
A. 用赤铁矿高炉炼铁:Fe2O3 + 3CO![]() 2Fe+3CO2 置换反应
2Fe+3CO2 置换反应
B. 加热混有二氧化锰的氯酸钾制取氧气:2KClO3![]() 2KCl+3O2↑ 分解反应
2KCl+3O2↑ 分解反应
C. 硫酸厂污水可用熟石灰中和处理:H2SO4 + Ca(OH)2=CaSO4+ H2O 复分解反应
D. 用红磷气中氧气含量:2P +5O2![]() 2P2O5 氧化反应
2P2O5 氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中正确的是( )
A. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部
C. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D. 分液操作时,分液漏斗下端紧靠烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是

A. 若该图表示的是活细胞的各化学元素的含量,则甲为碳元素
B. 若该图表示的是细胞各化学元素占干重的百分比,则甲为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com