
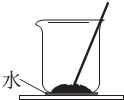
 将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )
将某固体氢氧化物M与NH4Cl置于如图所示的装置(玻璃片与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,发现玻璃片与烧杯粘在一起,则该反应所对应的能量变化关系图是( )| A. | 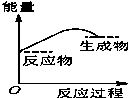 | B. | 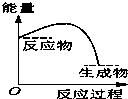 | C. | 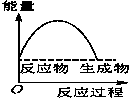 | D. |  |
科目:高中化学 来源: 题型:多选题
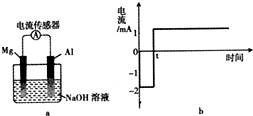 将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )
将打磨后的镁和铝平行插入1mol•L-1NaOH溶液中,用导线相连并连接电流传感器组成原电池装置(如图a),测得电流随时间变化曲线如图b所示(起始时镁作负极,t时刻电流出现反转),且镁条表面始终无明显气泡,则下列说法中错误的是( )| A. | 实验过程中,铝电极表面可能有气泡产生 | |
| B. | 0-t时刻,镁电极上发生反应:Mg-2e-+2OH-=Mg(OH)2 | |
| C. | t时刻时,铝和镁的金属活动性相同 | |
| D. | t时刻后,电池主要的总反应方程式:4Al+3O2+4OH-=4AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(H+)+c(X2-) | B. | c(Na+)=c(H2X)+c(HX-)+c(X2-) | ||
| C. | c(X2-)>c(H2X) | D. | c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.
;氧原子核外电子云有4 种不同的伸展方向,其最外层有6 种不同运动状态的电子.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、K+、OH-、SO42- | B. | Na+、Ca2+、HCO3-、Cl- | ||
| C. | NH4+、Al3+、AlO2-、H+ | D. | SO32-、Ba2+、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com