
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一,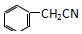 +2H2O+H2SO4$\stackrel{100-130℃}{→}$+NH4HSO4
+2H2O+H2SO4$\stackrel{100-130℃}{→}$+NH4HSO4 ,混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应.
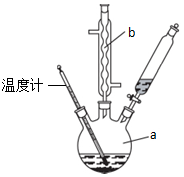
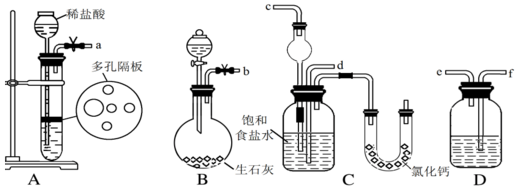
,混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应.分析 (1)根据仪器构造可知仪器b为球形冷凝管,使气化的液体冷凝回流,因为反应混合物中有浓硫酸,所以要将混合物倒入冷水中,反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度;
(2)分离苯乙酸粗品,利用过滤操作,过滤所用仪器有漏斗,烧杯,玻璃棒;
(3)苯乙酸和氢氧化铜生成苯乙酸铜,乙醇能增加苯乙酸的溶解度,便于充分反应;
(4)由反应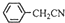 +H2O+H2SO4 $\frac{\underline{\;100-130℃\;}}{\;}$
+H2O+H2SO4 $\frac{\underline{\;100-130℃\;}}{\;}$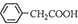 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$,根据产率=$\frac{实际产量}{理论产量}×100%$计算.
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$,根据产率=$\frac{实际产量}{理论产量}×100%$计算.
解答 解:(1)根据仪器构造可知仪器b为球形冷凝管,使气化的液体冷凝回流,因为反应混合物中有浓硫酸,所以要将混合物倒入冷水中,反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;
故答案为:球形冷凝管;冷凝回流;降低溶解度,使苯乙酸结晶;
(2)分离苯乙酸粗品,利用过滤操作,则需要的仪器为漏斗、烧杯、玻璃棒;
故答案为:过滤;acd;
(3)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,发生反应的化学方程式为: ,苯乙酸微溶于冷水,溶于乙醇,为了充分反应,混合溶剂中加乙醇增大苯乙酸的溶解度,便于充分反应;
,苯乙酸微溶于冷水,溶于乙醇,为了充分反应,混合溶剂中加乙醇增大苯乙酸的溶解度,便于充分反应;
故答案为: ;增大苯乙酸的溶解度,便于充分反应;
;增大苯乙酸的溶解度,便于充分反应;
(4)由反应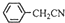 +H2O+H2SO4 $\frac{\underline{\;100-130℃\;}}{\;}$
+H2O+H2SO4 $\frac{\underline{\;100-130℃\;}}{\;}$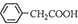 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44}{46.5}×100%$=95%;
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44}{46.5}×100%$=95%;
故答案为:95%.
点评 本题侧重物质制备实验及有机物性质的考查,把握合成反应及实验装置的作用为解答的关键,综合考查学生实验技能和分析解答问题的能力,题目难度中等,注意信息的处理及应用.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3难溶于水,是弱电解质 | |
| B. | 进行中和滴定操作时眼睛应注视锥形瓶中溶液颜色的变化 | |
| C. | 用pH试纸测溶液的pH应预先润湿 | |
| D. | 蒸干FeCl3溶液可得到FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体中含有Na+、Cl-,所以NaCl晶体能导电 | |
| B. | CO2溶于水能导电,所以CO2是电解质 | |
| C. | BaSO4难溶于水,BaSO4是非电解质 | |
| D. | Cl2的水溶液能够导电,但Cl2既不是电解质也不是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 溶液中不存在Fe3+ | |
| C. | 加入少量盐酸,则溶液中Fe3+浓度会减小 | |
| D. | 体系中存在着氢氧化铁的沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①、③的操作都是过滤 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是精馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
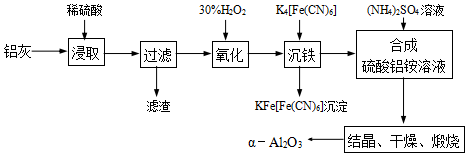

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
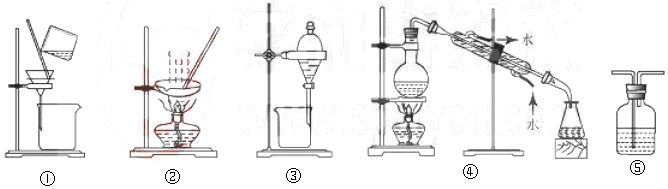
| A. | 粗盐提纯,选①和② | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 用NaOH溶液吸收少量C12选⑤ | D. | 分离Na2CO3溶液和CH3COOC2H5,选④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2>HI>H2SO3>NO | B. | H2SO3>HI>FeCl2>NO | ||
| C. | I2>FeCl2>H2SO3>NO | D. | NO>FeCl2>H2SO3>HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com