
”¾ĢāÄæ”æNH4Al(SO4)2”¤12H2OĖ׳Ęļ§Ć÷·Æ£¬ĘäŠŌÖŹĪČ¶Ø£¬ŹĒ»ÆѧŹµŃé³£ÓƵĻł×¼ŹŌ¼Į”£ÓĆĢ¼ĖįĒāļ§ÓėĮņĖįÄĘæÉŅŌÖʱø“æ¾»µÄļ§Ć÷·Æ£¬Öʱø¹ż³ĢČēĶ¼£¬ĻĀĆęĖµ·Ø²»ÕżČ·µÄŹĒ
A.¼ÓČėNH4HCO3±„ŗĶČÜŅŗ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗNa++HCO3-=NaHCO3”ż
B.µ÷½ŚpHŹ±£¬ĪŖĮĖ¼õÉŁĖšŗÄ£¬Ģįøß²śĀŹ£¬æɽ«pHŹŌÖ½Ö±½Ó½žČėĀĖŅŗaÖŠ
C.²Ł×÷¢ņµÄ»ł±¾¹ż³ĢĪŖÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ
D.Čō¹żĮæµÄĘųĢåaĶØČėµ½±„ŗĶµÄ“æ¼īČÜŅŗÖŠ»įÓŠ¾§ĢåĪö³ö£¬øĆ¾§ĢåÓė¹ĢĢåaĻąĶ¬
”¾“š°ø”æB
”¾½āĪö”æ
A. Ģ¼ĖįĒāÄĘČܽā¶ČŠ”ÓŚNH4HCO3£¬¼ÓČėNH4HCO3±„ŗĶČÜŅŗ·¢Éś·“Ó¦Ļ“³öĢ¼ĖįĒāÄĘ¾§Ģ壬Ąė×Ó·½³ĢŹ½£ŗNa++HCO3-=NaHCO3”ż£¬¹ŹAÕżČ·£»
B. ²»Äܽ«pHŹŌÖ½Ö±½Ó½žČėĀĖŅŗaÖŠ£¬»į¶ŌŹŌ¼ĮŌģ³ÉĪŪČ¾£¬¹ŹB“ķĪó£»
C. ²Ł×÷¢ņŹĒ“Óļ§Ć÷·ÆČÜŅŗµĆµ½µĆµ½ļ§Ć÷·Æ¹ĢĢ壬ÓÉÓŚļ§Ć÷·Æ“ų½į¾§Ė®£¬ĖłŅŌ²ÉČ”Õō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢¹żĀĖ”¢Ļ“µÓ”¢øÉŌļµÄ·½·Ø»ńµĆ£¬¹ŹCÕżČ·£»
D. ĘųĢåaĪŖ¶žŃõ»ÆĢ¼£¬ĶØČėµ½±„ŗĶµÄ“æ¼īČÜŅŗÖŠ£¬Ņ²»į²śÉśĢ¼ĖįĒāÄĘ¾§ĢåĪö³ö£¬Óė¹ĢĢåa³É·ÖĻąĶ¬£¬¹ŹDÕżČ·”£
“š°øŃ”B”£


 ŗ£µķ»ĘøŌĆūŹ¦µ¼ŗ½ĻµĮŠ“š°ø
ŗ£µķ»ĘøŌĆūŹ¦µ¼ŗ½ĻµĮŠ“š°ø ĘÕĶØøßÖŠĶ¬²½Į·Ļ°²įĻµĮŠ“š°ø
ĘÕĶØøßÖŠĶ¬²½Į·Ļ°²įĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķĖłĮŠø÷×éĪļÖŹÖŠ£¬ĪļÖŹÖ®¼äĶعżŅ»²½·“Ó¦ÄÜŹµĻÖČēĶ¼ĖłŹ¾×Ŗ»Æ¹ŲĻµµÄŹĒ
X | Y | Z | ĪļÖŹ×Ŗ»Æ¹ŲĻµ | |
A | Cu | CuO | Cu(OH)2 |
|
B | S | SO3 | H2SO4 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A.AB.BC.CD.D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ĶéĢžAŌŚĶ¬ĪĀ”¢Ķ¬Ń¹ĻĀÕōĘųµÄĆܶȏĒH2µÄ36±¶£¬Ęä·Ö×ÓŹ½ĪŖ___________”£
(2)Š“³öĢģČ»Ļš½ŗµ„Ģå(2-¼×»ł-1£¬3-¶”¶žĻ©)µÄ½į¹¹¼ņŹ½_________”£
(3)Į¢·½Ķé![]() µÄŅ»ĀČ“śĪļÓŠ_________ÖÖ£¬ĖüµÄĮłĀČ“śĪļÓŠ_________ÖÖ”£
µÄŅ»ĀČ“śĪļÓŠ_________ÖÖ£¬ĖüµÄĮłĀČ“śĪļÓŠ_________ÖÖ”£
(4)ĻĀĮŠĪļÖŹµÄ·Šµć°“ÓÉøßµ½µĶµÄĖ³ŠņÅÅĮŠÕżČ·µÄŹĒ___________”£
¢ŁCH3(CH2)2CH3 ¢ŚCH3(CH2)3CH3 ¢Ū (CH3)3CH ¢Ü (CH3)2CHCH2CH3
A.¢Ś¢Ü¢Ł¢Ū B. ¢Ü¢Ś¢Ł¢Ū C.¢Ü¢Ū¢Ś¢Ł D.¢Ś¢Ü¢Ū¢Ł
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņNaOHŗĶNa2CO3»ģŗĻČÜŅŗÖŠµĪ¼Ó0.1 mol”¤L1Ļ”ŃĪĖį£¬CO2µÄÉś³ÉĮæÓė¼ÓČėŃĪĖįµÄĢå»żµÄ¹ŲĻµČēĶ¼”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
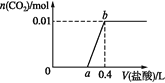
A. ŌŚ0~a·¶Ī§ÄŚ£¬Ö»·¢ÉśÖŠŗĶ·“Ó¦
B. ab¶Ī·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ![]()
C. a=0.3
D. Ō»ģŗĻČÜŅŗÖŠNaOHÓėNa2CO3µÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶµ„ÖŹ¼°Ęä»ÆŗĻĪļŌŚŗܶąĮģÓņÓŠÖŲŅŖÓĆĶ¾£¬Čē½šŹōĶÓĆĄ“ÖĘŌģµēĻßµēĄĀ£¬ĪåĖ®ĮņĖįĶæÉÓĆ×÷ɱ¾ś¼Į”£
(1)ĻņCuSO4ČÜŅŗÖŠ¼ÓČė¹żĮæNaOHČÜŅŗæÉÉś³É[Cu(OH)4]2-”£²»æ¼ĀĒæռ乹ŠĶ£¬[Cu(OH)4]2-µÄ½į¹¹æÉÓĆŹ¾ŅāĶ¼±ķŹ¾ĪŖ_____________________________£¬CuĪ»ÓŚŌŖĖŲÖÜĘŚ±ķµŚ¢ńB×唣Cu 2£«µÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ____________________”£
(2)µØ·ÆCuSO4”¤5H2OæÉŠ“³É[Cu(H2O) 4 ]SO4 ”¤H2O£¬Ęä½į¹¹Ź¾ŅāĶ¼ČēĻĀ£ŗ
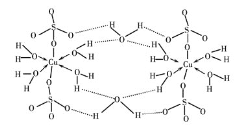
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ________(Ģī×ÖÄø)”£
A£®Ė®ÖŠµÄŃõŌ×Ó²ÉÓĆsp3 ŌÓ»Æ
B£®ŃõŌ×Ó²ĪÓėŠĪ³ÉÅäĪ»¼üŗĶĒā¼üĮ½ÖÖ»Æѧ¼ü
C£®Cu2+µÄ¼Ūµē×ÓÅŲ¼Ź½ĪŖ3d84s1
D£®µØ·ÆÖŠµÄĖ®ŌŚ²»Ķ¬ĪĀ¶ČĻĀ»į·Ö²½Ź§Č„
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æFe2(SO4)3ČÜŅŗæÉÓĆÓŚøÆŹ“¾ųŌµ°åÉĻµÄĶ²£¬ÖĘŌģÓ”Ė¢µēĀ·°å”£ĻÖÉč¼ĘĮĖŅ»øö·½°øČēĻĀ£¬“ÓøÆŹ“ŗóµÄ·ĻŅŗ(Ö÷ŅŖŗ¬Fe3+”¢Fe2+”¢Cu2+)ÖŠ»ŲŹÕĶ£¬²¢ÖŲŠĀ»ńµĆFe2(SO4)3ČÜŅŗ”£
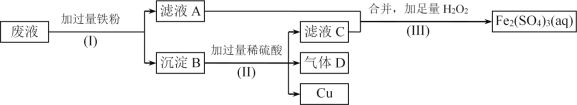
(1)²½Öč(I)ÖŠ·ÖĄė²Ł×÷Ćū³ĘĪŖ____________________”£
(2)³ĮµķBµÄÖ÷ŅŖ³É·ÖÓŠ____________________£¬ĘųĢåDµÄµē×ÓŹ½ĪŖ__________”£
(3)Š“³ö²½Öč(III)ÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½______________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄʶ¼ŹĒ֊ѧ³£¼ū»ÆѧŅ©Ę·”£
¢ń.ĻĀĆęŹĒŌŚŹµŃéŹŅÖŠÄ£Äā”°ŗīŹĻÖĘ¼ī·Ø”±ÖĘČ”NaHCO3µÄ×°ÖĆ£ŗ
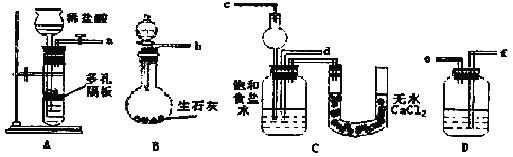
Ēė»Ų“šĻĀĮŠĪŹĢā£ØĢįŹ¾B·ÖŅŗĀ©¶·ÖŠĪŖÅØ°±Ė®£¬µĪČėÉÕĘææɲśÉś°±Ęų£©£ŗ
£Ø1£©×°ÖƵÄĮ¬½ÓĖ³ŠņŹĒ£ŗa½Ó___£¬___½Ó___£»b½Ó___”£
£Ø2£©¼ģ²é×°ÖĆĘųĆÜŠŌŗ󣬱ŲŠėĻČČĆ___£ØĢīA»ņB£©×°ÖĆĻČ·¢Éś·“Ó¦”£CÖŠÓĆĒņŠĪøÉŌļ¹Ü¶ų²»ÓĆÖ±µ¼¹Ü£¬Ęä×÷ÓĆŹĒ___”£
£Ø3£©CÖŠ¹ćæŚĘæÄŚ²śÉś¹ĢĢåµÄ×Ü»Æѧ·½³ĢŹ½ĪŖ___”£
¢ņ.Ķعż¼ÓČČ·Ö½āµÄ·½·ØæÉŅŌ²ā¶ØĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄʵÄŗ¬Įæ”£Č”13.08gĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄʵĻģŗĻĪļ³ä·Ö¼ÓČČ£¬½«Éś³ÉµÄCO2ĘųĢåĶØČė×ćĮæµÄ³ĪĒåŹÆ»ŅĖ®ÖŠ£¬²āµĆÉś³É³ĮµķµÄÖŹĮæĪŖ4.0g”£
£Ø4£©¼ÓČČŹ±·¢ÉśµÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ___”£
£Ø5£©Ō»ģŗĻĪļÖŠĢ¼ĖįÄĘŗĶĢ¼ĖįĒāÄʵÄĪļÖŹµÄĮæÖ®±ČĪŖ___”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĢśæóŹÆ£ØČōÖ»ŗ¬ĢśµÄŃõ»ÆĪļŗĶSiO2£©Č”36gČÜÓŚ¹żĮæµÄĻ”ŃĪĖįÖŠ£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļŗóµĆ5.6g²»ČÜĪļ£¬ĻņµĆµ½µÄĀĖŅŗÖŠ¼ÓČė×ćĮæµÄNaOHČÜŅŗ£¬¹żĀĖ”¢Ļ“µÓŗ󽫳Įµķ×ĘÉÕ£¬µĆ32gŗģ×ŲÉ«¹ĢĢ壮øł¾ŻĢāŅāĻĀĮŠ½įĀŪ²»ÕżČ·µÄŹĒ£Ø””””£©
A. ÓÉĢśæóŹÆ×Ŗ»ÆĪŖŗģ×ŲÉ«¹ĢĢåµÄ¹ż³ĢÖŠ·¢ÉśĮĖŃõ»Æ»¹Ō·“Ó¦
B. ČÜÓŚŃĪĖįŗóµĆµ½µÄĀĖŅŗÖŠn£ØFe2+£©£ŗn£ØFe3+£©=1£ŗ1
C. ĢśæóŹÆÖŠµÄĢśµÄŃõ»ÆĪļµÄ»ÆѧŹ½Ņ»¶ØŹĒFe3O4
D. ČōĻ”ŃĪĖįĪŖ3.0molL©1 400mL£¬·“Ó¦Ē°ŗóĢå»ż±ä»ÆŗöĀŌ²»¼Ę£¬ŌņĀĖŅŗÖŠŹ£ÓąH+µÄĪļÖŹµÄĮæÅØ¶ČŹĒ0.5molL©1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
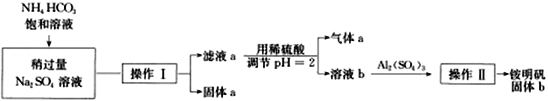
”¾ĢāÄæ”æĀĮŹĒÖŲŅŖµÄ½šŹō²ÄĮĻ£¬ĀĮĶĮæó(Ö÷ŅŖ³É·ÖŹĒAl2O3ŗĶÉŁĮæµÄSiO2”¢Fe2O3ŌÓÖŹ)ŹĒ¹¤ŅµÉĻÖĘČ”ĀĮµÄŌĮĻ”£ŹµŃéŹŅÄ£Äā¹¤ŅµÉĻŅŌĀĮĶĮæóĪŖŌĮĻÖĘļ§Ć÷·Æ¾§Ģå[NH4Al(SO4)2]µÄ¹¤ŅÕĮ÷³ĢČēĶ¼ĖłŹ¾£ŗ
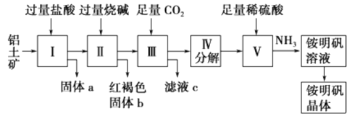
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)¹ĢĢåaµÄ»ÆѧŹ½ĪŖ________£¬¹ĢĢåb»ÆѧŹ½ĪŖ________£¬¢óÖŠĶØČė×ćĮæCO2ĘųĢå·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________”£
(2)ÓÉ¢õÖĘČ”ļ§Ć÷·ÆČÜŅŗµÄ»Æѧ·½³ĢŹ½ĪŖ__________________”£
(3)ÓÉ¢ń”ś¢ņ”ś¢ó”ś¢ō¶¼ŅŖÓƵ½µÄ·ÖĄė·½·ØŹĒ__________________£¬ÓÉļ§Ć÷·ÆČÜŅŗÖŠÖĘļ§Ć÷·Æ¾§ĢåµÄ²Ł×÷ŹĒ__________________”£
(4)Čē¹ūĻČĻņĀĮĶĮæó¼ÓČė¹żĮæĒāŃõ»ÆÄĘ£¬ŌŁ¼ÓČė¹żĮæŃĪĖį£¬“ĖŹ±Ź×ĻČ³öĻֵĹĢĢåaŹĒ__________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com