
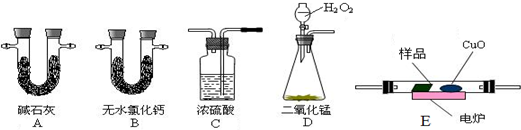
分析 (1)实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入E中的氧气、D用来制取反应所需的氧气、E是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,据此对各装置进行排序;
(2)浓硫酸可以吸收氧气的中的水分,避免影响测定结果;
(3)题中该实验方法只能获得有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量或摩尔质量;
(4)根据题干数据计算出该有机物的实验式,再根据核磁共振氢谱表示的意义确定该有机物的结构简式.
解答 解:(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选置的连接顺序应是:D→C→E→B→A,
故答案为:DCEBA;
(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果,
故答案为:除去氧气中的水蒸气;
(3)由上题干测量数据能够计算出该有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量或摩尔质量,最简式的n倍等于其摩尔质量数值,计算得到分子式,所以B正确,
故答案为:B;
(4)A管质量增加0.88g为二氧化碳的质量,n(CO2)=0.88g÷44g.mol-1=0.02mol,n(C)=n(CO2)=0.02mol,
B管质量增加0.36g是水的质量,n(H2O)=0.36g÷18g.mol-1=0.02mol,n(H)=2n(H2O)=0.04mol,
从而可推出含氧元素的质量为:0.44g-12g/mol×0.02mol-1g/mol×0.04mol=0.16g,n(O)=$\frac{0.16g}{16g/mol}$=0.01mol,
设最简式为CXHYOZ,则n(C):n(H):n(O)=0.02mol:0.04mol:0.01mol=2:4:1,
故该物质最简式为C2H4O,
该有机物蒸气对氢气的相对分子质量为22,则该有机物的摩尔质量为:2g/mol×22=44g/mol,其相对分子量为44,
设该物质分子式为(C2H4O)n,44n=44,解得:n=1,
故该物质分子式为C2H4O,
又根据题意:它的核磁共振氢谱上有两个峰,其强度比为3:1,可推出该有机物的结构简式为:CH3CHO,与该有机物相对分子质量相同的烃为C3H8是丙烷,丙烷结构简式为CH3CH2CH3,则它的一氯代物有2种,
故答案为:CH3CHO; 2.
点评 本题考查有机物的分子式的实验测定,题目难度中等,关键在于清楚实验的原理,掌握燃烧法利用元素守恒确定实验式的方法,试题侧重考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol羟基与17 g NH3所含电子数都为NA | |
| B. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32 g | |
| C. | 常温常压下,28 g C2H4、C3H6的混合气体中含有碳原子的数目为2NA | |
| D. | 适量铜粉溶解于1 L 0.5 mol•L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;5:3.
;5:3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 | |
| C. | 同系物的分子量数值一定相差14的整数倍 | |
| D. | 同系物的化学性质相似,物理性质随碳原子数的递增呈现规律性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 涂油漆 | |
| B. | 海轮在海洋上航行,为防止船体腐蚀,常在船体上镶上铜块 | |
| C. | 在金属表面进行电镀 | |
| D. | 改变金属内部结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 50% | C. | 66.7% | D. | 80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com