
 H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |
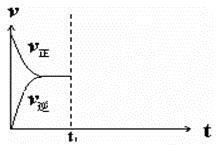
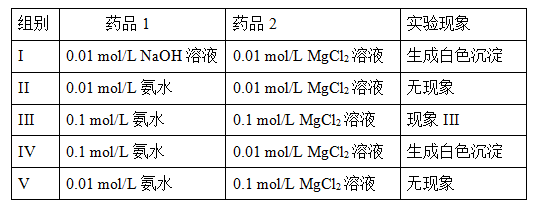
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
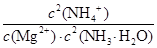 ;K=
;K=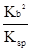
 H2(g) + CO2(g)
H2(g) + CO2(g) 。
。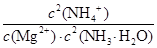 。K=
。K= =
=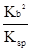


科目:高中化学 来源:不详 题型:填空题
 CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。 )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)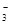 )
) c(CO
c(CO )
)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在固定体积的密闭容器中发生可逆反应A(s)+B(g)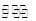 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 |
B.对于反应C(s)+CO2(g)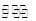 2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率也一定增大 |
C.向0.1mol·L-1的NH3·H2O中加入氯化铵固体,则溶液中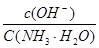 增大 增大 |
D.常温下向Mg(OH)2悬浊液中加入MgCl2浓溶液后,溶液中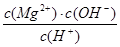 不变 不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )| A.N2、H2、NH3的百分含量相等 | B.3v(N2)正= v(H2)逆 |
| C.定容容器中,气体的密度不变 | D.N2、H2、NH3的浓度之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
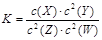 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是A.该反应可表示为X(g) + 2Y(g) 2Z(g) + 2W(g) 2Z(g) + 2W(g) |
| B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小 |
| C.增大反应容器的压强,该反应速率一定增大 |
| D.升高温度,W(g)体积分数增加,则正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: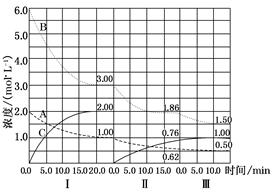
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com