
 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示: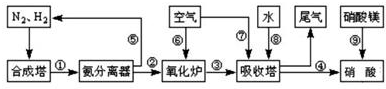
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
分析 (1)根据平衡常数表达式以及各种物质的浓度知识来回答;
(2)温度和平衡常数间的关系取决于平衡受温度的影响情况;
(3)对于放热反应,温度升高,则化学平衡向逆向移动;
(4)根据盖斯定律来计算反应的焓变,进而书写热化学方程式;
(5)氨气在纯氧中燃烧,生成氮气和水,燃料电池中,燃料做负极.
解答 解:(1)根据题意:CO+H2O(g)?CO2 +H2
初始浓度:0.2 0.3 0 0
变化浓度:0.12 0.12 0.12 0.12
平衡时的浓度:0.08 0.18 0.12 0.12
则K=$\frac{0.12×0.12}{0.08×0.18}$=1,
故答案为:1;
(2)对于放热反应,温度越高,则化学平衡逆向移动,导致平衡常数减小,所以T1<300℃,即T1<573K,
故答案为:<;
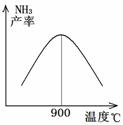
(3)对于放热反应,温度升高,则化学平衡向逆向移动,所以氨气的产率减小,
故答案为:温度高于900℃时,平衡向左移动;
(4)根据题意:①$\frac{1}{2}$CH4(g)+2NO2(g)═2NO(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-574kJ•mol-1)=-287kJ•mol-1;
$\frac{1}{2}$CH4(g)+2NO(g)═N2(g)+$\frac{1}{2}$CO2(g)+H2O(g)△H=$\frac{1}{2}$×(-1160kJ•mol-1)=-580kJ•mol-1;
根据盖斯定律反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)可以看成是①+②,所以△H=-287kJ•mol-1-580kJ•mol-1=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(5)氨气在纯氧中燃烧,生成氮气和水,在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-→N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题是一道工业合成氨的综合性知识题目,可以根据所学知识进行回答,难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | Na2CO3溶液能使酚酞试液变红:CO32-+H2O?HCO3-+OH- | |
| C. | 0.lmol•L-l CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| D. | 向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+(aq)═2Fe( OH)3(s)+3Mg2+(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同 | |
| B. | 无法比较 | |
| C. | 依次为0.12mol/L、0.24mol/L、0.36mol/L | |
| D. | 依次为0.06mol/L、0.12mol/L、0.18mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Na+ NO3- CO32- | B. | Na十 Fe3+ SCN- SO42- | ||
| C. | K+ Na十 Cl- AlO2- | D. | Al3+ Na+ Cl- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向正反应方向移动,c(H+)增大 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动,c(H+)减少 | |
| C. | 加入少量0.1mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动,c(CH3COO-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g | B. | 4g | C. | 8g | D. | 10g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com