
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:分析 (1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断;
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式;
(4)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=$\frac{△c}{△t}$计算A物质的平均反应速率.
解答 解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物,
故答案为:A;
(2)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为:0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为:2A?B+3C,
故答案为:2A?B+3C;
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,则v(A)=$\frac{0.8mol/L}{2min}$=0.4mol/(L•min),
故答案为:0.4mol/(L•min).
点评 本题考查物质的量浓度随时间变化的曲线、化学反应速率的计算等知识,题目难度中等,试题旨在考查学生对基础知识的掌握情况,根据图象曲线变化正确判断反应物、生成物为解答关键,注意掌握化学反应速率的计算方法.


科目:高中化学 来源: 题型:选择题
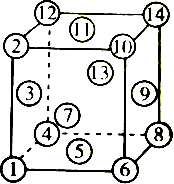
| A. | ④⑤⑥⑩⑪⑫ | B. | ②③④⑤⑥⑦ | C. | ①④⑤⑥⑧ | D. | ①②⑪⑭⑧⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
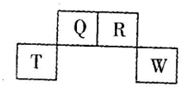
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中只有共价键没有离子键 | |
| D. | Q可形成多种含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
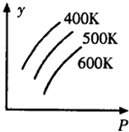
| A. | 平衡时,混合气体中R的百分含量 | B. | 平衡时,混合气中G的百分含量 | ||
| C. | G的转化率 | D. | L的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 | B. | 53 | C. | 78 | D. | 131 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 | |
| C. | 晶体中一定存在化学键 | |
| D. | 正四面体分子中键角只能是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com