
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
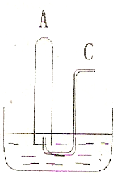 如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为________;通过导气管C往余下0.5a mL 气体的试管A中持续通人氧气,A 中可能观察到的现象是:________.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为________mL,水槽B中溶液的物质的量浓度为________mol?L-1(设溶液的体积仍为500mL)
如图所示:在B水槽中装有500mL水,容积为amL的试管A 充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中.充分反应后,试管A中余下气体的体积为0.5a mL,则原混合气体中NO2和NO的物质的量之比为________;通过导气管C往余下0.5a mL 气体的试管A中持续通人氧气,A 中可能观察到的现象是:________.当试管A中充满气体时停止通入氧气,然后将试管取出水槽,则共通入氧气的体积为________mL,水槽B中溶液的物质的量浓度为________mol?L-1(设溶液的体积仍为500mL)查看答案和解析>>
科目:高中化学 来源: 题型:单选题




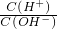 =1×1014的溶液:
=1×1014的溶液: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com