
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
分析 100mL 1mol•L-1 MgCl2溶液中的Cl-浓度为:1mol/L×2=2mol/L,氯离子浓度与溶液体积无关,只与溶质浓度及化学式组成有关,据此对各选项进行判断.
解答 解:100mL 1mol•L-1 MgCl2溶液中的Cl-浓度为:1mol/L×2=2mol/L,
A.150 mL 1mol•L-1NaCl溶液中,氯离子浓度为1mol/L,与氯化镁溶液中的氯离子浓度不相等,故A错误;
B.75 mL 0.5mol•L-1CaCl2溶液中,氯离子的浓度为:0.5mol/L×2=1mol/L,与氯化镁溶液中的氯离子浓度不相等,故B错误;
C.150 mL 2 mol•L-1KCl溶液中,氯离子浓度为2mol/L,与氯化镁溶液中的氯离子浓度相等,故C正确;
D.75mL 1mol•L-1AlCl3溶液中的氯离子浓度为:1mol/L×3=3mol/L,与氯化镁溶液中的氯离子浓度不相等,故D错误;
故选C.
点评 本题考查了物质的量浓度计算与判断,题目难度中等,掌握物质的量浓度的概念及计算方法为解答关键,注意明确离子的物质的量浓度与溶液体积大小无关,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成相同 | |
| B. | Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同 | |
| C. | 达到平衡时Ⅰ途径的vA等于Ⅱ途径的vA | |
| D. | 达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是
按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是| a | b | 实验现象预期 | 结论 | |
| A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
| B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
| C | 生铁 | 饱和NaCl溶液 | 导管中发生倒吸 | 生铁发生吸氧腐蚀 |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁做催化剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-H之间是sp形成的σ键,C-C之间全是未参加杂化的2p轨道形成的π键 | |
| B. | C-C之间是sp形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相平行 | |
| D. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相垂直 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
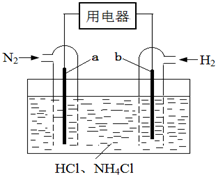 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com