
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
分析 同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比;先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项.
解答 解:对于3A(g)+B(g)?2C(g)+2D(g)反应,都转化为A表示的速率进行比较,
(1)v(A)=0.6mol•L-1•min-1;
(2)v(B)=0.007mol•L-1•S-1=0.42mol•L-1•min-1,则v(A)=3v(B)=3×0.42mol•L-1•min-1=1.26mol•L-1•min-1,
(3)v(C)=0.4mol•L-1•min-1,则v(A)=$\frac{3}{2}$v(C)=$\frac{3}{2}$×0.4mol•L-1•min-1=0.6mol•L-1•min-1,
(4)v(D)=0.8mol•L-1•min-1,则v(A)=$\frac{3}{2}$v(D)=$\frac{3}{2}$×0.8mol•L-1•min-1=1.2mol•L-1•min-1,
故选B.
点评 比较反应速率常用的两种方法:(1)归一法:将同一反应中的不同物质的反应速率转化成同一物质的反应速率,再较小比较.(2)比值法:用各物质的量表示的反应速率除以对应各物质的化学计量数,数值大的反应速率快.
比较反应速率时注意(1)反应速率的单位要相同(2)单位时间内反应物或生成物的物质的量变化大,反应速率不一定快,反应速率是用单位时间内浓度的变化量来表示的.


科目:高中化学 来源: 题型:选择题
| A. | 第一主族的元素称为碱金属 | |
| B. | 第二周期元素的最高化合价依次递增,并等于它所处的主族序数 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:c(HCO3-)+c (CO32-)=c(Na+) | |
| C. | 常温下,稀释0.1 mol/L的氨水,水的电离程度减小 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
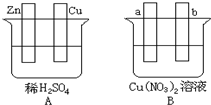 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
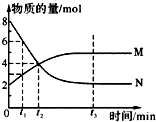 在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中气体M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为:2M?N | B. | t2时,正逆反应速率相等 | ||
| C. | t3时,正反应速率大于逆反应速率 | D. | t1时,N的浓度是M浓度的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能 /(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com