
科目:高中化学 来源: 题型:
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
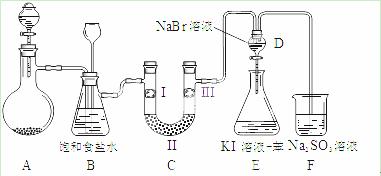
⑴制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: ▲ 。
装置B中饱和食盐水的作用是_____▲ ____;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_____▲____。
⑵装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入__▲__。
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
⑶设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__▲__色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是___________▲____________。
⑷装置F中用足量的Na2SO3溶液吸收余氯,试写出相应的离子反应方程式:___▲___。
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2Cr2O7是一种受热易分解的盐,在分解的过程中发生了氧化还原反应。下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是
A.CrO3 + NH3 + H2O B.Cr2O3 +NH3 + H2O
C.CrO3 + N2 + H2O D.Cr2O3 +N2+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
登山运动员常利用氢化钙固体作为能源提供剂。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:

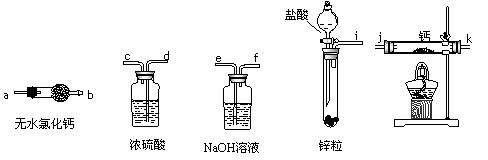

A B C D E
图1
查阅资料:①钙易与水反应生成碱和气体。
②氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。
(1)请按气流方向连接顺序i接( ),( )接( ),( )接( ),k接 a
(填仪器接口的字母编号)。
(2)装置A的作用是 ;装置C的作用是 。
 (3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
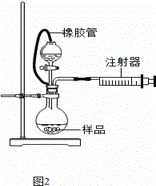
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度。请完善下列实验步骤。
①样品称量 ②加入足量的________溶液(填化学式),搅拌、过滤 ③_______、________(填操作名称) ④称量碳酸钙的质量
(5)乙同学利用图2装置测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00 mL刻度处,反应结束后充分冷却,活栓最终停留在57.04 mL刻度处。(上述气体体积均在标准状况下测定)
试通过计算求样品中氢化钙的纯度: 。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
(1)该同学应选择________ mL的容量瓶。
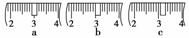
(2)其操作步骤如右图 所示,则如图操作应在下图中的__________(填选项字母)之间。
所示,则如图操作应在下图中的__________(填选项字母)之间。
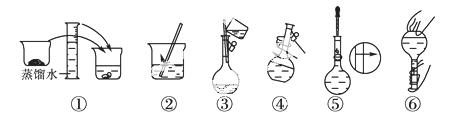
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)。
②容量瓶中原来有少量蒸馏水,浓度会________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作会导致实验结果偏低的是
①配制100 g 10%的CuSO4溶液,称取10 g CuSO4晶体溶于90 g水中 ②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮 ③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g ④用酸式滴定 管量取98%、密度为1.84 g/cm3的浓H2SO4配制200 mL 2 mol/L的稀H2SO4时,先平视后仰视
管量取98%、密度为1.84 g/cm3的浓H2SO4配制200 mL 2 mol/L的稀H2SO4时,先平视后仰视
A.只有① B.只有②
C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是 ( )
A.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
B.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
C.常温下在c(H+)=1×10-13 mol∙L-1的溶液中能大量存在Mg2+、Cu2+、SO42-、NO3-
D.加入铝粉能产生氢气的溶液中大量存在NH4+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
(1)与氯元素同族的短周期元素的原子结构示意图为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液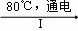 NaClO3溶液
NaClO3溶液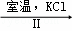 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+ H2O═ NaClO3+ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 .
(4)一定条件下,在水溶液中1mol Cl﹣、ClOx﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.
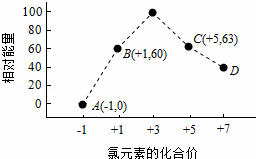
①D是 ﹣ (填离子符号).
②B→A+C反应的热化学方程式为 (用离子符号表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com