
己二酸是一种重要的有机二元 酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备。反应原理:
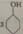 +8HNO3
+8HNO3 3HOOC(CH2)4COOH+8NO
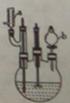
3HOOC(CH2)4COOH+8NO +7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
+7H2O,反应装置(部分夹持装置和热源已省略)如图所示。
实验步骤:
I.在60mL三颈烧瓶中加入16.0mL50%硝酸(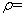 1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
1.31g·cm-1)和微量(0.01g)偏钒酸铵,瓶的正口安装电动搅拌器,两侧口分别安装仪器a和b。用仪器b滴加5.3mL环己醇,搅拌器用玻璃搅拌棒,仪器a另一端连接气体吸收装置,用纯碱液作吸收溶液。
II.首先将瓶内液体加热到50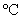 左右,开动搅拌器,滴入环己醇(
左右,开动搅拌器,滴入环己醇(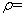 0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90
0.9624g·cm-1),使反应处于微沸状态,滴加完毕后于90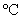 左右水浴加热20分钟,至反应完毕。
左右水浴加热20分钟,至反应完毕。
III.趁热倒出瓶中混合液于烧杯内,烧杯置于冰水浴中,静置冷却,析出产品,过滤,用少量冷水洗涤沉淀,干燥后称重。
IV.将粗产品在水中进行重结晶操作。
请回答下列问题:
(1)仪器a的名称是_________________。仪器b在使用前应_________________。
(2)偏钒酸铵的作用是_______________。
(3)反应完成后,趁热倒出反应液的目的是___ ________________
________________ 。
。
(4)本实验中己二酸的理论产量为______________g。
(5)用纯碱液吸收尾气时发生的相关化学反应为:
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ①
NO+NO2+Na2CO3=2NaNO2+NaNO3+CO2 ②
现用1000g质量分数为21.2%的纯碱吸收液吸收尾气,每产生22.4L(标准状况下)CO2 时,吸收液 质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
质量就增加44g,则吸收液中NaNO2和NaNO3的物质的量之比为_________。
【知识点】化学基本仪器的使用,化学实验的基本操作,产量的计算,化学方程式的有关计算 J5
【答案解析】(1)冷凝管(或球形冷凝管);检查是否漏水(各1分)
(2)催化剂(1分)
(3)反应刚结束的时候,反应液容易倒出,若任其冷却至室温,己二酸会结晶析出,不容易倒出,造成产品的损失(1分)
(4)7.4(2分)
(5)5:3(3分)
解析:(1)仪器a的名称是冷凝管(或球形冷凝管);仪器b 为分液漏斗,在使用前应检查是否漏水。
为分液漏斗,在使用前应检查是否漏水。
(2)在此反应过程中利用了硝酸的强氧化性氧化环己醇得到己二酸,故偏钒酸铵的作用是催化剂。
(3)从题目中信息可知己二酸随着温度的降低溶解度减小,故当其冷却至室温时己二酸会结晶析出,不容易倒出,造成产品的损失,因此要趁热倒出反应液。
(4)m(HNO3)= 16.0mL×1.31g·cm-1×50%=10.48g,n(HNO3)= 10.48g/63g·mol=0.16mol,
m(环己醇)=5.3mL×0.9624g·cm-1=5.1g,n(环己醇)= 5.1g/100g·mol=0.051mol,
根据 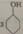 ~8HNO3
~8HNO3
3mol 8mol
可得硝酸过量,故得到的己二酸的物质的量与环己醇的物质的量相等,故n(己二酸)= 0.051mol,m(己二酸)=7.4g。
(5)1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加了44g.
①2NO2+Na2CO3=NaNO2+NaNO3+CO2↑△m=48g
NO+NO2+Na2CO3=2NaNO2+CO2↑△m=32g
设由NO2与纯碱反应产生的CO2为amol,
由NO和NO2与纯碱反应产生的CO2为bmol,列方程计算
a+b=1
48a+32b=44
a=0.75mol
b=0.25mol
n(NaNO2):n(NaNO3)=5:3
【思路点拨】本题考查了化学基本仪器的使用,化学实验基本操作方法,产率的计算以及利用方程式及守恒法的有关计算等,题目难度中等。


科目:高中化学 来源: 题型:
按照混合物、纯净物、强电解质、弱电解质、非电解质的顺序排列正确的一组是( )
A.盐酸、氯气、BaSO4、CO2、SO2
B.硫酸、氨水、醋酸、乙醇、NO2
C.漂白粉、胆矾、NH4Cl、CH3COOH、CO2
D.干冰、氯水、HCl、HClO、CO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去括号内杂质的有关操作正确的是( )
A.苯(汽油):加少量蒸馏水振荡,待分层后分液
B.乙醇(水):加新制的生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):通入氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列粒子在溶液中能大量共存的是
| 选项 | 离子或分子 |
| A | K+、NO3-、I-、H2SO3 |
| B | Na+、Fe3+、NO3-、SCN- |
| C | Al3+、NO3-、SO32-、OH- |
| D | NH4+、Na+、SO42-、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法正确的是
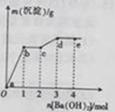
A. 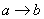 时的沉淀成分为BaSO4与Mg(OH)2
时的沉淀成分为BaSO4与Mg(OH)2
B. 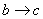 时发生的离子反应为H++OH-=H2O
时发生的离子反应为H++OH-=H2O
C. c点时的溶液中
D. 原混合溶液中:n(HCl)=2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学学习、研究中,类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A. CO2和Na2 O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
O2反应生成Na2CO3,推测:SO2和Na2O2反应生成Na2SO3
B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
C. Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3
D. F、C l、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
l、 Br,、I的单质熔点依次升高,推测:N、 P、As、 Sb、Bi单质熔点也依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量CO2气体通入水玻璃中,然后蒸干,再在高温下充分燃烧,最后所得固体物质是
A. Na2SiO3 B. Na2CO3、Na2SiO3 C. Na2CO3、 SiO2 D. SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
 A、若
A、若 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D、若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸和K2CO3反应时,能使反应的最初速率明显加快的是( )
A.将盐酸用量增加一倍 B.盐酸的浓度增加一倍,用量减半
C.温度升高30 ℃ D.增加K2CO3粉末的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com