
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
微粒 | EO2﹣ | EO3﹣ |
立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________.
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
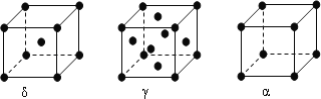
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________,δ、γ、α三种晶胞的边长之比为____________。
【答案】(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3(2)P>S>Si
(3)NH3>AsH3>PH3(4)V形;三角锥形(5)AB (6)4:6:3,![]()
【解析】
试题分析:元素X最高价氧化物的化学式为X2O5,则X为第ⅤA族元素,前四周期的A、B、C、D均与元素X紧密相邻,即位于X的四周,则A、B、C、D位于元素周期表的第二、三、四周期,X为P元素,B、D同主族且B元素的原子半径是同族元素中最小的,B、X、D同主族,则B为N元素,D为Sn元素,C的最高价氧化物对应的水化物是强酸,C为S元素,A为Si元素。
(1)D是Sn元素,原子序数为33,其基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
(2)A、C、X分别为Si、S、P,根据元素周期律,同周期元素从左向右,第一电离逐渐增大,但第ⅡA族和第ⅤA族由于最外层处于全满和半满状态,第一电离能高于相邻族的元素,所以Si、S、P的第一电离能大小顺序为P>S>Si;
(3)B、X、D氢化物分别为NH3、PH3、AsH3,因为氨分子之间有氢键的存在,所以氨的沸点较大,则AsH3>的相对分子质量大于PH3,所以沸点也高于PH3,所以它们的沸点由高到低的顺序为NH3>AsH3>PH3;
(4)EO2-为ClO2-,EO3-为ClO3-,它们的中心原子氯原子的价层电子对数均为(7+1)/2=4,所以氯原子都是sp3杂化,在ClO2-中有两个Cl-O键,所以ClO2-的空间构型为V形,而在ClO3-中有三个Cl-O键,所以ClO3-的空间构型为三角锥形;
(5)B2H4为N2H4,A.N2H4分子间与NH3相似,可形成氢键,A正确;B.N2H4分子中N原子的价层电子对数为(5+1+1+1)/2=4,所以氮原子是sp3杂化,B正确;C.N2H4分子中N原子之间是单键,所以没有π键,C错误;D.N2H4是分子晶体,所以晶体变为液态时破坏的是分子间作用力和氢键,D错误;答案选AB;
(6)F元素基态原子M层上有5对成对电子,则F的核外电子排布式为1s22s22p63s23p63d64s2,所以F为Fe元素;δ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于晶胞的体心,补全晶胞可知配位数为8,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12。α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,所以δ、γ、α三种晶胞中Fe原子的配位数之比为4:6: 3;设铁原子的直径为a,根据晶胞结构图可知,δ晶胞的边长为![]() 、γ晶胞的边长为
、γ晶胞的边长为![]() 、α晶胞的边长为a,所以δ、γ、α三种晶胞的边长之比为:
、α晶胞的边长为a,所以δ、γ、α三种晶胞的边长之比为:![]() :
:![]() :a=
:a=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列各项应用涉及的化学原理完全相同的是
A. 用氯化铁或液氯处理废水 B. 用铁槽车或铝槽车运输浓硫酸
C. 用二氧化硫或氯气漂自织物 D. 用亚硫酸钠或氯水处理二氧化硫尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品﹣3PbOPbSO4H2O (三盐),主要制备流程如下:
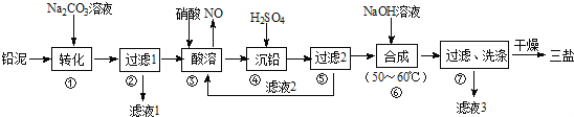
(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为______________.
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为______________(写化学式).
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为______________;滤液2中溶质主要成分为______________(写化学式).
(4)步骤⑥合成三盐的化学方程式为______________.
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡酸苯乙酯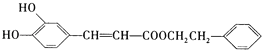 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
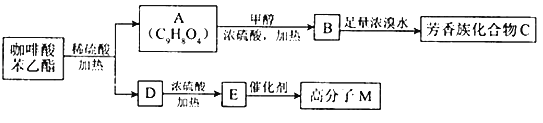
请填写下列空白.
(1)D分子中的官能团是______________;高分子M的结构简式是______________.
(2)写出A→B反应的化学方程式:______________.
(3)B→C发生的反应类型有______________.
(4)A的同分异构体很多种,其中,同时符合下列条件的同分异构体有_________种.
①苯环上只有两个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应.
(5)以下对A具有的性质描述正确的是__________
a.1molA可消耗2molNaOH
b.一定条件下1molA最多能与1mol氢气加成
c.能发生银镜反应
d.能发生取代反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式:2AgCl+ Mg = Mg2++ 2Ag+2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应为AgCl+e-=Ag+Cl-
C.不能被KCl溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g20.0%的NaCl溶液,跟10.0g35.0%的NaCl溶液混合,得到密度为1.17g/cm-3的混合溶液。计算:
⑴该混合溶液中溶质的质量分数;
⑵该混合溶液溶质的物质的量浓度;
⑶在500g水中需溶入多少摩尔NaCl,才能使其浓度恰好与上述混合溶液的浓度相等?
(计算结果保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在指定溶液中一定能大量共存的是
A. 使pH试纸呈蓝色溶液中:I-、Cl-、NO3-、Cu2+
B. 使酚酞呈深红色的溶液中:Na+、Cl-、H+、NO3-
C. 含大量Ag+的溶液中:K+、Na+、NO3-、SO42-
D. 含大量OH-的溶液中:CO32-、Cl-、F-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后再滴加0.1 mol·L-1的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
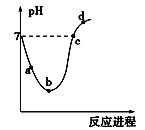
A.a点所示的溶液中[H+]=[Cl-]+[HClO]+[OH-]
B.b点所示的溶液中[H+]>[Cl-]>[HClO]>[ClO-]
C.c点所示的溶液中[Na+]=[HClO]+[ClO-]
D.d点所示的溶液中[Na+]>[ClO-]>[Cl-]>[HClO]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com