
| A | ||
| B | ||
| C |
| A. | A是一种活泼金属元素 | |
| B. | C的最高价氧化物的水化物是强酸 | |
| C. | B的氢氧化物是强碱 | |
| D. | C的最高价氧化物对应的水化物能与NaOH溶液反应 |
分析 短周期的三种元素A、B、C在周期表中的位置关系如图,结合元素周期表结构可知,A为H元素,B为Be元素、C为Al元素,据此结合元素周期律知识解答.
解答 解:短周期的三种元素A、B、C在周期表中的位置关系如图,结合元素周期表结构可知,A为H元素,B为Be元素、C为Al元素,
A.根据分析可知,A为H元素,属于非金属元素,故A错误;
B.C为Al元素,其最高价氧化物对应水合物为氢氧化铝,氢氧化铝为两性氢氧化物,碱性较弱,故B错误;
C.B为Be元素,与Mg位于同一主族,氢氧化镁为中强碱,则氢氧化铍为弱碱,故C错误;
D.C的最高价氧化物对应水合物为氢氧化铝,氢氧化铝为两性氢氧化物,能够与氢氧化钠溶液反应,故D正确;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,明确元素周期表结构为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
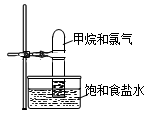 将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.
将如图装置放置在光亮的地方,随后观察到如下实验现象:大试管内壁上有油状液滴生成、饱和食盐水中有少量固体析出、黄绿色气体颜色变浅、试管内液面有所上升.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤水点豆腐、明矾净水的原理都是破坏胶体的介稳性 | |
| B. | 铁、铝、铜制容器放置空气中都能在表面形成致密氧化物 | |
| C. | 单晶Ge是半导体,可以作为光电转换材料用于太阳能电池 | |
| D. | 检测酒后驾车者呼出气中的乙醇属于化学检测方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
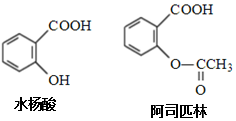
| A. | 阿司匹林分子中存在碳碳双键和碳氧双键 | |
| B. | 阿司匹林的分子式为C9H10O4,能与NaHCO3反应 | |
| C. | 水杨酸可以发生取代反应和加成反应 | |
| D. | 水杨酸的同分异构体中,含有羧基和羟基的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
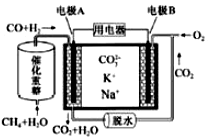
| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol 电子 | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素性质或原子结构的部分信息 |
| W | 元素的离子核外无电子 |
| X | 地壳中含量最多的元素 |
| Y | 元素的离子半径在该周期中最小 |
| Z | Z的单质是淡黄色固体 |
| A. | W与Z形成的化合物在常温下为气体 | |
| B. | Y的最高价氧化物对应的水化物显强碱性 | |
| C. | X和Z形成的常见化合物能形成酸 | |
| D. | 简单氢化物的稳定性:X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃C% 压强/MPa | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com