
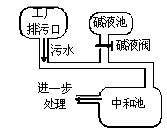
下图为某盐酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱液中和。已知废水中盐酸的质量分数为0.73%,且废水的流量为5.0kg?s-1(即每秒钟排出5kg废水)。
(1)若碱液是NaOH溶液,且流量为1.0kg?s-1,则该碱液的质量分数是多少?
(2)现将碱液改为K2CO3溶液,将实现既中和废水又得到钾肥(KCl)之目的。若K2CO3溶液的质量分数与NaOH溶液的相等,则K2CO3溶液的流量是多少?
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
下图为盐酸厂废水处理示意图,排污口流出的废水用碱液池流出的碱中和。已知废水中盐酸的质量分数为0.73%,且废水的流量为5.0kg / s(即每秒钟排出5kg废水)。
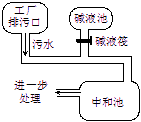
(1)若碱液是NaOH溶液,且流量为1.0kg/s,则该碱液的质量分数是多少?
(2)现将碱液改为K2CO3溶液,将实现既中和废水、又得到钾肥(KCl)之目的。若K2CO3溶液质量分数与NaOH溶液相等,则K2CO3溶液流量是多少?
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省“江南十校”高三第一次模拟考试化学试卷(解析版) 题型:填空题
某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:

已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:
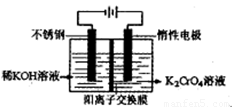
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比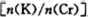 为d,则此时的铬酸钾的转化率为
。
为d,则此时的铬酸钾的转化率为
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省威海市高三上学期期末考试化学试卷(解析版) 题型:计算题
(1)已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。

(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
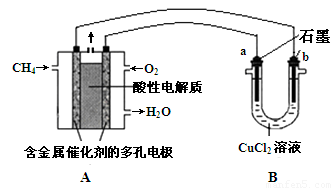
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
查看答案和解析>>
科目:高中化学 来源:2010年新疆哈巴河县高级中学高三上学期第一次月考化学试题 题型:选择题
某冶金厂废水的pH为4.5,含超标10倍的Pb2+。该厂处理废水的下列设计中,比较合理的是 ( )
A.用离子交换法除去Pb2+
B.在废水中加硫酸,生成PbS04沉淀
C.在废水中加石灰,调节pH到11.0,使Pb2+转化为氢氧化物沉淀
D.在废水中加NaOH,调节pH到11.0,使Pb2+转化为氢氧化物沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com