
�о���Աͨ���Ա�������PM2��5�Ļ�ѧ����о����֣�����β����ȼú��Ⱦ�ֱ� ռ4����l8��
I����1�����ھ�������β���ķ�ӦΪ��2NO(g)+2CO(g) 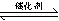 2CO2(g)+N2(g)����֪�÷�Ӧ��570Kʱ��ƽ�ⳣ��Ϊ1��1059������Ӧ���ʼ���������˵����ȷ���ǣ�
2CO2(g)+N2(g)����֪�÷�Ӧ��570Kʱ��ƽ�ⳣ��Ϊ1��1059������Ӧ���ʼ���������˵����ȷ���ǣ�
| A��װ��β������װ�õ������ų��������в��ٺ���NO��CO |
| B�����β������Ч�ʵ����;����ʹ�ø�Ч���� |
| C������ѹǿ������ƽ�����ƣ���ʵ�ʲ����п�ͨ����ѹ�ķ�ʽ����侻��Ч�� |
| D�����β������Ч�ʵij��÷����������¶� |
 N2(g)+CO2(g)
N2(g)+CO2(g)  H=akJ��mol-1����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
H=akJ��mol-1����ij�ܱ���������һ�����Ļ���̿��NO������(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�| Ũ��/mol��L-1 ʱ��/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
I��1��B ��2���� 0.25 �� 0.0042mol???L-1?min-1������CO2Ũ�� �� <
II��1��SO2(g)+2CO(g)=S(s)+2CO2(g) ?H=(2b��a)kJ?mol?1
��2����2MgSO4+CO  2MgO+SO2+CO2+SO3
2MgO+SO2+CO2+SO3
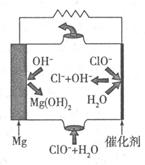
�� Mg��2e?+2OH?=Mg(OH)2��Mg��2e?=Mg2+ Mg+ClO?+H2O=Cl?+Mg(OH)2
�������������I��1���÷�Ӧ��ƽ�ⳣ���Ѿ��ܴ��ˣ��������β������Ч�ʹؼ��Ǽӿ췴Ӧ���ʡ�A����Ϊ�÷�ӦΪ���淴Ӧ������װ��β������װ�õ������ų�����������Ȼ����NO��CO������B��ʹ�ø�Ч�������Լӿ췴Ӧ���ʣ��������β������Ч�ʵ����;����ʹ�ø�Ч��������ȷ��C������ѹǿ������β�����ŷź�������������D�������¶ȣ�����β�����ŷź�������������
��2���ٷ�Ӧ���е�20minʱ�ﵽƽ�⣬��������ʽ���м���:
C(s)+2NO(g) N2(g)+CO2(g)
N2(g)+CO2(g)
��ʼŨ�ȣ�mol?L?1�� 0.100 0 0
ת��Ũ�ȣ�mol?L?1�� 0.050 0.025 0.025
ƽ��Ũ�ȣ�mol?L?1�� 0.050 0.025 0.025
�÷�Ӧ��ƽ�ⳣ��K= 0.025��0.025��0.0502=0.25��
�� v(NO)=(0.1000mol?L?1��0.058mol?L?1)��10min =0.0042mol???L-1?min-1��30min�ı�ijһ��������Ӧ���´ﵽƽ���Ӧ��NO��Ũ�ȼ�С��������N2Ũ������CO2��Ũ�ȼ�С�����Ըı�����������ǣ�����CO2Ũ�ȡ�
�� T1�� 30minʱ��NO��N2��CO2��Ũ��֮��Ϊ2:1:1�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��l��˵�������¶ȣ�ƽ�����淴Ӧ�����ƶ����÷�ӦΪ���ȷ�Ӧ��a < 0
II��1�����������仯ͼ�ɵ��Ȼ�ѧ����ʽ��S(s)+O2(g)=SO2(g) ?H1="a" kJ?mol?1 CO(g)+1/2O2(g)=CO2(g) ?H2="b" kj/mol��д����SO2��ȥCO�Ļ�ѧ����ʽ��ע��״̬�����ݸ�˹�������ʱ䣬?H=��?H1+ 2?H2 = =(2b��a)kJ?mol?1���ɵ��Ȼ�ѧ����ʽ��
��2����CO��ԭMgSO4���Ʊ��ߴ�MgO�����ɵ����ʵ�����SO2��SO3������Ԫ���غ�ͬʱ����CO2����ƽ�ɵû�ѧ����ʽ��2MgSO4+CO  2MgO+SO2+CO2+SO3��
2MgO+SO2+CO2+SO3��
�� MgΪ���ý�����Ϊ����ʧȥ���ӣ��缫����ʽΪ��Mg��2e?+2OH?=Mg(OH)2��Mg��2e?=Mg2+���ܷ�ӦΪClO?�ڼ��������°�Mg����ΪMg(OH)2�����ӷ���ʽΪ��Mg+ClO?+H2O=Cl?+Mg(OH)2
���㣺���⿼�黯ѧ��Ӧ���ʡ���ѧƽ�⡢��ѧ��Ӧ������ת����ԭ���ԭ����


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(4�֣���1mol��̬������ij�ֹ��ۼ���Ҫ���յ����������Ǹù��ۼ��ļ��ܡ��±���ijЩ���ۼ��ļ��ܣ�
| ���ۼ� | H-H | O=O | H-O |
| ����/kJ ��mol-1 | 436 | 498 | X |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����( COCl2)�����ϡ��Ƹ��ҩ�ȹ�ҵ����������;����ҵ�ϲ��ø�����CO��C12�ڻ���̿���ºϳɡ�
��1��ʵ�����п����ȷ�(CHC13)��˫��ˮֱ�ӷ�Ӧ�Ʊ��������䷴Ӧ�Ļ�ѧ����ʽΪ ��
��2����ҵ��������Ȼ��(��Ҫ�ɷ�ΪCH4)��CO2���и��������Ʊ�CO����֪CH4��H2��CO��ȼ����(��H)�ֱ�Ϊ?890.3kJ?mol?1��?285. 8 kJ?mol?1��?283.0 kJ?mol?1����1molCH4��CO2��Ӧ���Ȼ�ѧ����ʽ��
��3��COCl2�ķֽⷴӦΪCOCl2(g)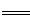 Cl2(g)��CO(g) ��H=��108kJ��mol��1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͬ��ʾ(��10min��14min��COCl2Ũ�ȱ仯����δʾ��)��
Cl2(g)��CO(g) ��H=��108kJ��mol��1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״������ͬ��ʾ(��10min��14min��COCl2Ũ�ȱ仯����δʾ��)��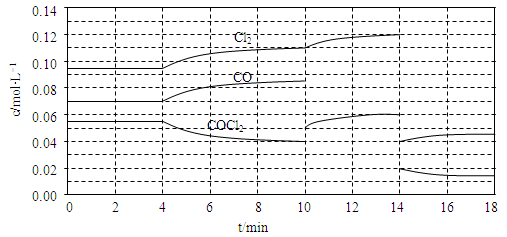
�ٱȽϵ�2 min��Ӧ�¶�T��2�����8min��Ӧ�¶�T��8���ĸߵͣ�T��2�� ____ T��8��(�<������>����=��)
�ڱȽϷ�Ӧ��COCl2��5?6min��15?16 minʱƽ����Ӧ���ʵĴ�С��v(5?6)
v(15?16)(�<������>����=��)��ԭ���� ��
�ۼ��㷴Ӧ�ڵ�8 minʱ��ƽ�ⳣ��K= �����г�������̣����������λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����̫���ֽܷ�ˮ����H2���ڴ���������H2��CO2��Ӧ�ϳ�CH3OH����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء���֪��H2(g)+1/2O2(g)=H2O(l) ��H=��285.8 kJ��mol��1��CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ��H=��726.5 kJ��mol��1��CO(g) +1/2O2(g)= CO2 (g) ��H=��283.0 kJ��mol��1��
��ش��������⣺
����̫���ֽܷ�18gˮ����Ҫ���ĵ�����Ϊ kJ��
�� Һ̬CH3OH����ȫȼ������CO��Һ̬H2O���Ȼ�ѧ����ʽΪ ��
��CO2�ϳ�ȼ��CH3OH��̼���ŵ��·������ݻ�Ϊ2 L���ܱ������У���2 mol CO2��6 mol H2����CO2��H2�ϳɼ״�����Ӧʽ��CO2(g)��3H2(g) CH3OH(g)��H2O(g)���������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ(ע��T1��T2������300 ��)��
CH3OH(g)��H2O(g)���������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ(ע��T1��T2������300 ��)��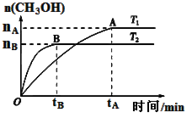
������˵����ȷ����
A���¶�ΪT2ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊ: v(CH3OH)��nB/tB mol��(L��min)��1
B��T2��T1��T2ƽ��ʱ���״��������٣����Ը÷�ӦΪ���ȷ�Ӧ
C���÷�Ӧ��T2ʱ��ƽ�ⳣ����T1ʱ��ƽ�ⳣ����
D������A��ķ�Ӧ��ϵ��T1�䵽T2��ƽ�������ƶ�
�����жϸ÷�Ӧ�Ѵﻯѧ��Ӧ�ȱ�־���� ������ĸ��
A��H2�İٷֺ������ֲ���
B��������CO2 Ũ����H2Ũ��֮��Ϊ1: 3
C�������л��������ܶȱ��ֲ���
D��CO2����������CH3OH�����������
�ȿ�ѧ��������CO2�ġ����ת���������о����罫CO2��H2�������1��4�������ͨ�뷴Ӧ�����ʵ������£���Ӧ�ɻ��һ����Դ��������»�ѧ����ʽ������֪��������Դ��
CO2��4H2 2H2O �� ��
2H2O �� ��
�� ��ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ���У��������ҺΪ���ԣ��ܷ�ӦʽΪ��2CH3OH + 3O2��2CO2��4H2O���������ķ�ӦʽΪ �������ķ�ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ƽ���ǻ�ѧ��Ӧԭ���е���Ҫ���ݡ���Ҫ��ش��������⣺
��1����֪��2SO2(g)+O2(g) 2SO3(g) ��H1 ƽ�ⳣ��ΪK1
2SO3(g) ��H1 ƽ�ⳣ��ΪK1
2NO(g)+O2(g) 2NO2(g) ��H2 ƽ�ⳣ��ΪK2
2NO2(g) ��H2 ƽ�ⳣ��ΪK2
��ӦNO2(g)+SO2(g) SO3(g)+NO(g)�Ħ�H="______" (�æ�H 1�ͦ�H 2��ʾ)���˷�Ӧ���¶��µ�ƽ�ⳣ��K=______(��K1��K2��ʾ)��
SO3(g)+NO(g)�Ħ�H="______" (�æ�H 1�ͦ�H 2��ʾ)���˷�Ӧ���¶��µ�ƽ�ⳣ��K=______(��K1��K2��ʾ)��
��2����֪A(g)+B(g)  C(g)+D(g)���÷�Ӧ��3L�ܱ������У������ֲ�ͬ�������½��з�Ӧ��A��B����ʼ���ʵ��Ƿֱ�Ϊ3.0mol��6.0mol������ʵ��I������ΪT1�档A�����ʵ�����ʱ��ı仯��ͼ��ʾ��
C(g)+D(g)���÷�Ӧ��3L�ܱ������У������ֲ�ͬ�������½��з�Ӧ��A��B����ʼ���ʵ��Ƿֱ�Ϊ3.0mol��6.0mol������ʵ��I������ΪT1�档A�����ʵ�����ʱ��ı仯��ͼ��ʾ��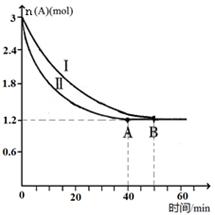
��ʵ�����ܸı��������_______________��
��T1��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ_____(�÷����� ʾ)���ﵽƽ��ʱ��A�ķ�Ӧ����Ϊ____��
��3����֪HCN��Һ�ĵ���ƽ�ⳣ��Ka=10��5mol?L��1��cƽ��(HCN)��c��ʼ(HCN)��ˮ�ĵ���ɲ��ƣ�����¶���0.1 mol?L��1��HCN��Һ��pH=_________��
��4������0.1mol?L��1 Na2CO3��Һ������Һ������Ũ���ɴ�С��˳����______�������Һ�м�ˮϡ�͵Ĺ����У�c(H2CO3)��____(��������䡱��С���� ��ͬ) ��c(H2CO3)/ c(CO32��)��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(1)�ڱ���¯�з�����Ӧ��
��Fe2O3(s)��3C(s) ===2Fe(s)��3CO(g) ��H����492.7 kJ��mol��1
��3CO(g)��Fe2O3(s) ===2Fe(s)��3CO2(g) ��H����25.2 kJ��mol��1
��2Fe2O3(s)��3C(s) ===4Fe(s)��3CO2(g) ��H�� kJ��mol��1��
(2)��Ȼ��(�Լ����)�ڹ�ҵ��������;�㷺����������ת������H2����Ҫת����Ӧ���£�
CH4(g)��H2O(g) ===CO(g)��3H2(g) ��H����206.2 kJ��mol��1
CH4(g)��2H2O(g) ===CO2(g)��4H2(g) ��H����165.0 kJ��mol��1
������Ӧ����ԭ�����е�CO��ʹ���ϳɴ����ж��������ȥ����ҵ�ϳ����ô���������CO��ˮ������Ӧ�����׳�ȥ��CO2��ͬʱ�ֿ��Ƶõ�����������ķ������˷�Ӧ��Ϊһ����̼�任��Ӧ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ú������Һ�����ִ���Դ��ҵ���ص㿼�ǵ���Դ�ۺ����÷������������������Ϊ��ú����ˮú��������ǰ�Ƚ����е�Һ������Ϊ��ú����CH3OH��
(1)��֪��CO2(g)��3H2(g)=CH3OH(g)��H2O(g)����H1
2CO(g)��O2(g)=2CO2(g)����H2
2H2(g)��O2(g)=2H2O(g)����H3
��ӦCO(g)��2H2(g)=CH3OH(g)�Ħ�H��______��
(2)��ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�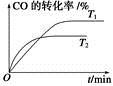
��T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1________K2(�����������������)��
����CO�ϳɼ״�ʱ��CO��250 �桢300 �桢350 ���´ﵽƽ��ʱת������ѹǿ�Ĺ�ϵ��������ͼ��ʾ��������c����ʾ���¶�Ϊ________ �档ʵ����������������250 �桢1.3��104 kPa���ң�ѡ���ѹǿ��������____________��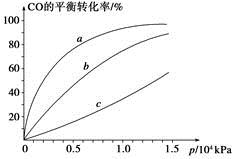
�������йظ÷�Ӧ��˵����ȷ����________(�����)��
A�����¡����������£��������ڵ�ѹǿ�������仯������淴Ӧ�ﵽƽ��
B��һ�������£�H2������������CO���������ʵ�2��ʱ�����淴Ӧ�ﵽƽ��
C��ʹ�ú��ʵĴ��������̴ﵽƽ���ʱ�䲢���CH3OH�IJ���
D��ij�¶��£���2 mol CO��6 mol H2����2 L�ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)��0.2 mol��L��1����CO��ת����Ϊ80%
(3)һ���¶��£���2 L�̶�������ܱ������м���1 mol CH3OH(g)��������Ӧ��CH3OH(g) CO(g)��2H2(g)��H2�����ʵ�����ʱ��仯��������ͼ��ʾ��
CO(g)��2H2(g)��H2�����ʵ�����ʱ��仯��������ͼ��ʾ��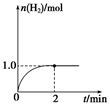
0��2 min�ڵ�ƽ����Ӧ����v(CH3OH)��__________�����¶��£���ӦCO(g)��2H2(g) CH3OH(g)��ƽ�ⳣ��K��__________����ͬ�¶��£�����ʼʱ����CH3OH(g)�����ʵ�����ԭ����2������__________(�����)��ԭ����2����
CH3OH(g)��ƽ�ⳣ��K��__________����ͬ�¶��£�����ʼʱ����CH3OH(g)�����ʵ�����ԭ����2������__________(�����)��ԭ����2����
A��ƽ�ⳣ�� B��CH3OH��ƽ��Ũ��
C���ﵽƽ���ʱ�� D��ƽ��ʱ������ܶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���Ŵ�����Ⱦ���������أ������ܼ��š�������ȫ�����������ŷţ��о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ�����������Ҫ���塣
��1����ͼ����101 kPa��298K������1mol NO2��1mol CO��Ӧ����1mol CO2��1mol NO�����е������仯ʾ��ͼ��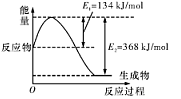
��֪��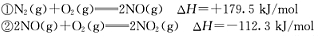
��д��NO��CO��Ӧ��������Ⱦ������Ȼ�ѧ��
��ʽ�� ��
��2����0.20 mol N02��0.10 mol CO����һ���ݻ��㶨Ϊ1L���ܱ������з�����Ӧ���ڲ�ͬ�����£���Ӧ�����в������ʵ�Ũ�ȱ仯״����ͼ��ʾ��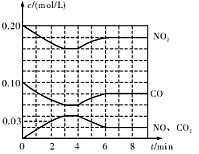
������˵����ȷ���� ������ţ���
a�������ڵ�ѹǿ�������仯˵���÷�Ӧ�ﵽ����
b�������������ٳ���0�� 20 mol NOʱ��ƽ��������Ӧ�����ƶ���K����
c�������¶Ⱥ�K��С��N02��ת���ʼ�С
d����������ڳ���He������Ӧ��������С��Ũ���������Է�Ӧ��������
�ڼ������NO��0��2 min��ƽ����Ӧ����v��NO��= mol��L-1��min-1
�۵�4 minʱ�ı�ķ�Ӧ����Ϊ ������¡����������¡�������
�ܼ��㷴Ӧ�ڵ�6 minʱ��ƽ�ⳣ��K= ���������¶Ȳ��䣬��ʱ���������г���CO��NO��0��060 mol��ƽ�⽫ �ƶ��������������������
��3����ѧ��������ͼ��ʾװ����ԭ���ԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ�ϡ��为����ӦʽΪ ������0.25 mol SO2�����գ���ͨ�����ӣ�H+������Ĥ��H+�����ʵ���Ϊ mol��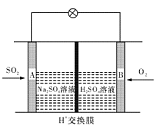
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ�ϳ������÷�Ӧ���������������飬���ǰ��渱��Ӧ�ڡ�
��C2H4(g)+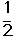 O2(g) ��
O2(g) ��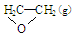 ; ��H1 ��C2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g); ��H2
; ��H1 ��C2H4(g)+3O2(g) �� 2CO2(g)+2H2O(g); ��H2
��1��д������������ȼ�յ��Ȼ�ѧ��Ӧ����ʽ����____________________________��
��2����ҵ�����У���ͨ��ijһ��ʩ���ӿ췴Ӧ�ٶ��Է�Ӧ��Ӱ���С���Ӷ���������������Ч�ʡ���ҵ������ȡ�����ִ�ʩ��_______________��
A�����߷�Ӧ��ϵ���¶�B��������ϵ��������Ũ��
C��ʹ�ú��ʵĴ���D�����ͷ�Ӧ��ϵ��ѹǿ
��3����֪C=C��O=O��C��C���ֱܷ�Ϊa kJ��mol-1��b kJ��mol-1��c kJ��mol-1������������C��O����Ϊ kJ��mol-1��
��4����Ӧ�ڿ�����Ƴ�ȼ�ϵ�أ����������������Һ��������Ӧʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com