
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
分析 ①植物油是酯类;
②CH2F2不存在同分异构体现象;C2H6O可能为醇,还可能为醚;
③牺牲阳极的阴极保护法的原理是原电池;
④0.01mol•L-1的盐酸的pH=2;
⑤根据实验测定酸碱滴定的有关知识来回答;
⑥盐的水解促进水的电离;
⑦硼酸的酸性弱于碳酸;
⑧Fe2(SO4)3溶液加热蒸干后得硫酸铁固体;
⑨钢铁的析氢腐蚀和吸氧腐蚀的负极反应均为铁放电;
⑩氢氧化镁电离的氢氧根离子可与铵根离子反应.
解答 ①植物油是酯类,含有氧元素,故不是烃,即不是碳氢化合物,故错误;
②CH2F2不存在同分异构体现象;C2H6O可能为乙醇,还可能为二甲醚,基存在同分异构体,故错误;
③牺牲阳极的阴极保护法的原理是原电池,而非电解池,故错误;
④0.01mol•L-1的盐酸的pH=2,和醋酸溶液的酸性相同,故两溶液混合后溶液的pH不变,故错误;
⑤实验测定酸碱滴定曲线时,要保证整个过程测试和记录pH的间隔不一定相同,注意记录颜色突变过程所消耗的碱的量是关键,故错误;
⑥盐的水解促进水的电离,而常温下pH=5的NH4Cl溶液和pH=9的NaHCO3溶液中水电离出的氢离子和氢氧根的浓度均为10-5mol/L,故水的电离程度相同,故正确;
⑦硼酸的酸性弱于碳酸,故向硼酸溶液中加入碳酸钠溶液后,无气体生成,故错误;
⑧AlCl3溶液,Na2SO3溶液蒸干后分别得到氢氧化铝和硫酸钠固体,而Fe2(SO4)3溶液加热蒸干后得硫酸铁固体,故错误;
⑨钢铁的析氢腐蚀和吸氧腐蚀的负极反应均为铁放电:Fe-2e-=Fe2+,即负极反应式相同,故正确;
⑩氢氧化镁电离的氢氧根离子可与氯化铵溶液中的铵根离子反应,导致Mg(OH)2的溶解平衡右移而逐渐溶解,而不是NH4+水解出的H+与Mg(OH)2电离出的OH-结合的原因,故错误.
故选A.
点评 本题综合考查了金属的腐蚀和防护、有机物的元素组成和盐类水解的应用,综合性较强但难度不大,应注意的是向氢氧化镁中加入氯化铵溶液后氢氧化镁逐渐溶解的原理.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:实验题
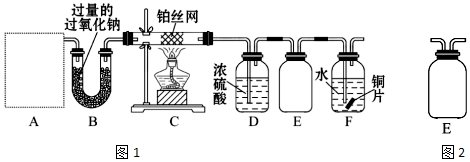
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
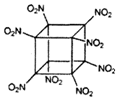 科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )
科学家研制出的八硝基立方烷(结构如图所示,碳原子未画出)是一种新型高能炸药,爆炸分解得到无毒、稳定的气体.下列说法错误的是( )| A. | 分子中C、N间形成极性共价键 | B. | 1mol该分子中含8mol-NO2 | ||
| C. | 该物质既有氧化性又有还原性 | D. | 该物质爆炸产物是NO2、CO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2═HSO3-+NH4+ | |
| B. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 向含0.1mol•L-1Na2CO3和0.2mol•L-1NaOH的混合溶液中加入等体积的0.15mol•L-1的硫酸:CO32-+3H++2OH-═2H2O+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,上述对青篙素的提取过程属于物理变化 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com