
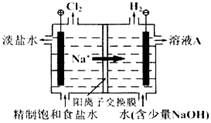
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑ HCl+HClO,增大HCl的浓度可使平衡向逆向移动,减少氯气在水中的溶解度,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡向逆向移动,减少氯气在水中的溶解度,有利于氯气的溢出。 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑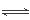 HCl+HClO,根据平衡移动原理知,增大盐酸的浓度可使平衡向逆向移动,这样减少了氯气的溶解度,有利于氯气的溢出。
HCl+HClO,根据平衡移动原理知,增大盐酸的浓度可使平衡向逆向移动,这样减少了氯气的溶解度,有利于氯气的溢出。

科目:高中化学 来源:不详 题型:单选题

| A.a为负极、b为正极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

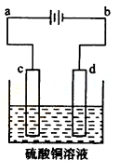
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题:
CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电。下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝。回答下列问题: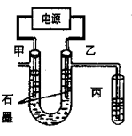
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后对铁制品失去保护作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a 为电源的正极 |
| B.通电一段时间后,石墨电极附近溶液先变红 |
| C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑ |
D.电解饱和食盐水的总反应是: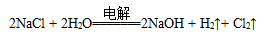 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
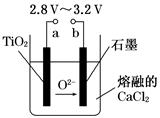
| A.a为电源的正极 |
| B.石墨电极上发生还原反应 |
| C.阴极发生的反应为:TiO2+4e-=Ti+2O2- |
| D.每生成0.1 mol钛,转移电子0.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阴极 | B.阳极 | C.正极 | D.负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com