
����Ŀ������������ɫ���ӷ���Һ�壬�ڻ���������;�㷺��ʵ����ģ��һ�ֹ�ҵ�Ʊ����������Ҫ�������£�
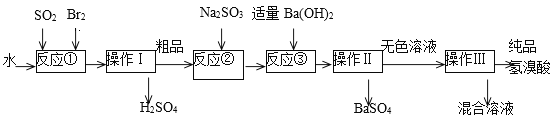
��1��д����Ӧ�ٵ����ӷ���ʽ___________�÷�Ӧ��Ҫ�ڱ�ˮԡ�н��У����ܵ�ԭ����____________��
��2������I������__________��
��3����Ӧ����Na2SO3��Ŀ����_____________________��
��4���������õ��IJ����������ձ���_____________________��
��5����ҵ�������Ƶõ���������е����Ļ�ɫ�����Ǽ�����ͬѧ�����ʵ�����̽����
�ټ�ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ��Fe3����������֤���ü������õ��Լ�Ϊ_________������������ɹ۲쵽������Ϊ____________________��
����ͬѧ���蹤ҵ������ʵ���ɫ����Ϊ____��������֤���ü�������ķ���Ϊ________________��
���𰸡�SO2+Br2+2H2O=SO42��+2Br��+4H+ ��ֹBr2��HBr�ӷ� ���� ��ȥ��Ʒ�е��� ��������©�� KSCN ȡ�����μ�KSCN��Һ������Һ��Ϊ��ɫ����֤����Fe3�� Br2�����壩 ȡ��������CCl4��������������Ͳ�ʳ�ɫ���Ⱥ�ɫ��֤����Br2
��������
���̷�Ӧ�Ң��з�����Ӧ SO2+Br2+2H2O=H2SO4+2HBr��������������������������Ĵ�Ʒ�����壩����Ӧ�Ң��м���Na2SO3��ԭ��Ʒ�е�Br2�����ᷴӦ����SO42- ����������������˵����ᱵ��������ɫ��Һ��������õ���Ʒ�����ᡣ
(1)Br2����ǿ�����ԣ�����Һ�н�SO2����ΪH2SO4����������ԭΪHBr��Br2����SO2�ų��ܶ�������Br2��HBr�ӷ���
(2)�ɹ������̿�֪��������Ϊ���ܵ���Һ��ֵķ��룬Ӧ������
(3)��Ʒ�п��ܺ���Ϊ��Ӧ��Br2��Ӧ��ȥBr2��
(4)������������Һ���壬�ò����ǹ��ˣ����ݹ��˲����ķ����ж�ʹ�õ�������
(5) ����KSCN��Һ����Fe3+���μ�KSCN��Һ����Һ���Ѫ��ɫ��
���ɹ������̿�֪����Һ�п��ܺ���Br2��������CCl4��ȡ�������顣
(1)Br2����ǿ�����ԣ�����Һ�н�SO2����ΪH2SO4����������ԭΪHBr����Ӧ�����ӷ���ʽΪ��SO2+Br2+2H2O=SO42-+2Br-+4H+��Br2����SO2�ų��ܶ�������Br2��HBr�ӷ���ʹ�ñ�ˮ��������ϵ�¶ȣ���ֹBr2��HBr�ӷ���ʹ��Ӧ��ȫ���ʴ�Ϊ��SO2+Br2+2H2O=SO42-+2Br-+4H+����ֹBr2��HBr�ӷ���
(2)�ɹ������̿�֪��������Ϊ���ܵ���Һ��ֵķ��룬Ӧ�����ʴ�Ϊ������
(3)��Ʒ�п��ܺ���Ϊ��Ӧ��Br2������Na2SO3����ȥ��Ʒ��δ��Ӧ����壬�ʴ�Ϊ����ȥ��Ʒ�е��壻
(4)������������Һ���壬�ò����ǹ��ˣ��õ��IJ����������ձ�����������©�����ʴ�Ϊ����������©����
(5)����KSCN��Һ����Fe3+��������ȡ������Һ�μ�KSCN��Һ����Һ���Ѫ��ɫ��˵��������ʵ���ɫ����Ϊ��Fe3+���ʴ�Ϊ��KSCN��ȡ�����μ�KSCN��Һ������Һ��Ϊ��ɫ����֤����Fe3����
���ɹ������̿�֪����Һ�п��ܺ���Br2��֤���ü�������ķ������ý�ͷ�ι�ȡ�Ƶõ����������Թ��У��μ�CCl4������ֹ���²�ʳȺ�ɫ��֤����Br2���Ի�ɫ���ʴ�Ϊ��Br2�����壩��ȡ��������CCl4��������������Ͳ�ʳ�ɫ���Ⱥ�ɫ��֤����Br2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л����˵����ȷ���ǣ�������
A. ��֬��������ˮ��Ϊ��������͵�С���Ӻ���������
B. ���������HCOOCH3����������ͬ���칹��
C. ʯ�ʹ��ѻ�����ҪĿ������߷������IJ���
D. �۱�ϩ�Ľṹ��ʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ��ϵ�д���H2O��ClO-��CN-��HCO3����N2��Cl������������Ӧ�����в��ClO- ��N2�����ʵ�����ʱ��ı仯����ͼ��ʾ���й��ж���ȷ����
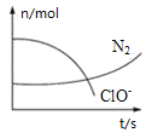
A.��������ClO-����ԭ������HCO3��
B.��Ӧ��ϵ�з�Ӧ�������������������
C.�������뻹ԭ�������ʵ���֮��Ϊ5��2
D.����2.24L N2����״����ʱת�Ƶ���0.5 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
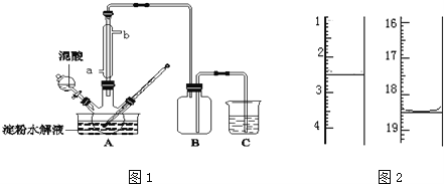
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦmA(g)+nB(g)=eC(g)+fD(s)����H��������Ӧ��Ļ�ѧ��������Ͷ�ϣ���һ�������½��з�Ӧ���÷�Ӧ�ﵽƽ��ʱC����������������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ������������ȷ����
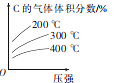
A.�÷�Ӧ����H >0
B.�û�ѧ����ʽ��m+n>e+f
C.��������ɼӿ�����Ӧ���ʣ��淴Ӧ���ʲ���
D.��ƽ���ĺ�ѹ�������ٳ���һ����C���ﵽ��ƽ��ʱ��C��Ũ����ԭƽ��ʱ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д���������ǣ� ��
A. ʹ��̪���ɫ����Һ�У�Na����Al3����SO42����Cl��
B. ![]() =1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
=1��10��13mol��L��1����Һ�У�NH4����Ca2����Cl����NO3��
C. ��Al��Ӧ�ܷų�H2����Һ�У�Fe2����K����NO3����SO42��
D. ˮ�����c(H��)=1��10��13mol��L��1����Һ�У�K����Na����AlO2����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���ֱ�������pH��Ϊa��CH3COOH��Һ��HCN��Һ�м�ˮϡ�ͣ�ϡ��������Һ��pH�仯����Һ����Ĺ�ϵ��ͼ��ʾ��
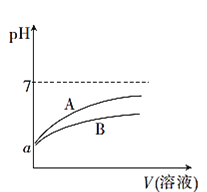
��֪25��ʱ��HCN�ĵ���ƽ�ⳣ��Ka=6.2��10-10��CH3COOH�ĵ���ƽ�ⳣ��Ka=1.7��10-5
(1)��ʾCH3COOH��Һ��pH�仯���Ƶ�������____(����A������B��)��
(2)pH��Ϊa��CH3COOH��Һ��HCN��Һ�����ʵ����ʵ���Ũ�Ƚϴ����____(�ѧʽ)��
(3)25��ʱ����Ũ�ȵ�NaCN��Һ��pH___����>��=������<��)CH3 COONa��Һ��pH��
(4)25��ʱ����20mL0.01mol��L-1CH3COOH��Һ����μ���0.01mol��L-1KOH��Һ����pH=7ʱ������KOH��Һ�����____(�����<��)20mL��
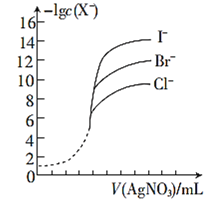
(5)����ͬŨ�ȵ�AgNO3��Һ�ֱ�ζ�Ũ����ͬ�ĺ�Cl����Br����I���Ļ����Һ����ͼ��ȷ�����ȳ�����������______��(�����ӷ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĵ��ʼ��仯������������������к���Ҫ����;��
��1�����Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϡ���һ���������õ����������ϳɰ�����Ȼ�����ð���������ȡ���ᡣ���������������У�������������Ϊ85%��д������������ȡ����ķ�Ӧʽ____________����0.2tҺ̬������������Ũ��Ϊ40%������______________ǧ�ˡ�
��2����27.2 g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡ����0.5 L������������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���1.0 mol��L-1��NaOH��Һ1.0 L����ʱ��Һ�����ԡ�������������ȫ��������������Ϊ39.2 g��
��Cu��Cu2O�����ʵ���֮�ȣ�____________
����������ʵ���Ũ�ȣ�___________
��3����30mLNO��O2�������ͨ�����NaOH��Һ�У���ַ�Ӧ����Һ��ֻ���������ʣ�������ˮ�⣩����ʣ���������Ϊ2mL����ԭ���������NO��O2����ȣ�______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1934�������������Ӻ��![]() �õ�һ����Ȼ�粻���ڵĺ���
�õ�һ����Ȼ�粻���ڵĺ���![]() ��������������ص��Ⱥӡ��䷢���ı仯���£�
��������������ص��Ⱥӡ��䷢���ı仯���£�![]() +
+![]() ��
��![]() +
+![]() �������й�˵���������
�������й�˵���������
A.![]() ��
��![]() ����ԭ�ӻ�Ϊͬλ��
����ԭ�ӻ�Ϊͬλ��
B.��![]() ��������=������=���������
��������=������=���������
C.�ñ仯ͬ����ѭ�����غ㶨��
D.�ñ仯˵��ԭ�Ӻ��ڻ�ѧ��Ӧ��Ҳ�ܷ����仯
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com