
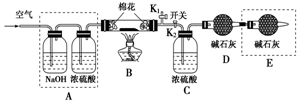
 为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x
为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x分析 (2)要排除空气中的水以及二氧化碳的干扰,浓硫酸吸收气体中的水蒸气,最后的碱石灰的作用:吸收空气中水蒸气和CO2等来回答;
(3)开始之前要先通空气,排尽装置中的空气;
(4)MgCO3受热分解生成氧化镁和二氧化碳,Mg(OH)2受热分解生成氧化镁和水;
(5)碱式碳酸镁可以看成是碳酸镁和氢氧化镁的混合物,根据二氧化碳确定碳酸镁的量,根据水确定氢氧化镁的量,据此确定化学式即可;
解答 解:(2)A框中NaOH的作用是吸收空气中的二氧化碳气体,避免影响测定二氧化碳的量,浓硫酸的作用是吸收分解生成的水蒸气,装置E的作用是防止空气中的CO2和水蒸气进入装置D中,引起实验误差,
故答案为:吸收CO2;吸收水;防止空气中的CO2和水蒸气进入装置D中,引起实验误差;
(3)要排除空气中的水以及二氧化碳的干扰,开始之前要先通空气,排尽装置中的空气,再进行试验,在装好试剂后,加热前应进行的操作是关闭K2,打开K1,
故答案为:K2,K1;
(4)MgCO3受热分解生成氧化镁和二氧化碳,反应的化学方程式为:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$ MgO+CO2↑,Mg(OH)2受热分解生成氧化镁和水,反应的化学方程式为:Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O,
故答案为:MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$ MgO+CO2↑;Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O;
(5)设水合碱式碳酸镁的化学式为mMgCO3•nMg(OH)2,
mMgCO3•nMg(OH)2•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)MgO+mCO2↑+(n+x)H2O
40(m+n) 44m 18(n+x)
1.60 1.32 0.72
则:$\frac{40(m+n)}{1.60}$=$\frac{44m}{1.32}$=$\frac{18(n+x)}{0.72}$,解得x=3,n=1,m=3,即3MgCO3•Mg(OH)2•3H2O,
故答案为:3MgCO3•Mg(OH)2•3H2O;
点评 本题考查学生物质的组成和含量的测定,注重实验能力的考查,注意实验原理的探究是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 物理 | B. | 化学 | C. | 地理 | D. | 生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
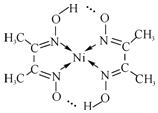
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题: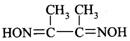 )常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.
)常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入NaOH溶液,产生白色沉淀,则原溶液一定含有Mg2+ | |
| B. | 滴入BaCl2溶液和稀硝酸,产生白色沉淀,则原溶液一定含有SO42- | |
| C. | 滴入稀硫酸产生无色无味使澄清石灰水浑浊的气体,则原溶液一定含有CO32- | |
| D. | 滴入KSCN溶液呈无色,再通入少量Cl2后呈红色,则原溶液一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
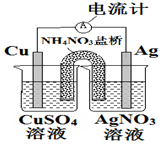
| A. | 盐桥中的NH4+离子向左侧烧杯移动 | |
| B. | 铜电极上发生的反应为Cu-2e-═Cu2+ | |
| C. | 外电路中的电子是从银电极流向铜电极 | |
| D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Mg与足量盐酸反应生成氢气的体积为11.2升 | |
| B. | 标准状况下,11.2L SO2所含的原子数为1.5NA | |
| C. | 8gCH4所含的氢原子数为0.5NA | |
| D. | 46g NO2和N2O4的混合物所含的分子数为1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com