
分析 n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,结合电子守恒及原子守恒计算.
解答 解:(1)n(SO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由电子守恒可知,n(Cu)=$\frac{0.2mol×(6-4)}{(2-0)}$=0.2mol,其质量为0.2mol×64g/mol=12.8g,
答:反应中消耗的铜的质量为12.8g;
(2)由Cu原子守恒可知,n(CuSO4)=0.2mol,该溶液中CuSO4的物质的量浓度是$\frac{0.2mol}{0.5L}$=0.4mol/L,
答:该溶液中CuSO4的物质的量浓度是0.4mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、电子守恒为解答的关键,侧重分析与应用能力的考查,注意守恒法的应用,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向二氧化锰固体中加入浓盐酸后加热,将产生的气体通入淀粉碘化钾溶液液 | 溶液变蓝 | Cl2具有氧化性 |
| B | 向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水 | 溴水褪色 | SO2具漂白性 |
| C | 向蔗糖溶液中加稀硫酸,水浴加热后,加入新制氢氧化铜,加热 | 溶液变蓝 | 蔗糖水解产物没有还原性 |
| D | 无水乙醇与浓硫酸共热170℃,将产生的气体通入酸性高锰酸钾溶液 | 溶液褪色 | 乙烯可被化酸性高锰酸钾氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
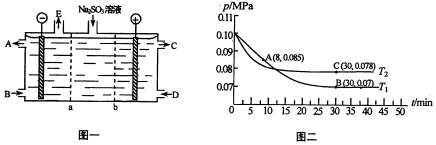
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
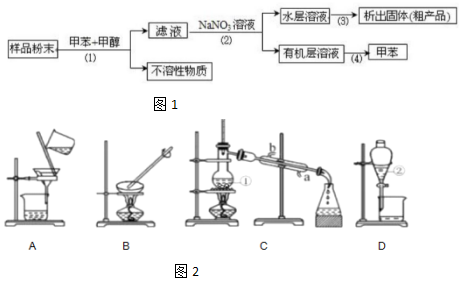
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 还原性:SO2>Fe2+>Cr3+ | B. | 氧化性:Cr2O72->SO2>Fe3+ | ||
| C. | Cr2O72-能将Na2SO3氧化成Na2SO4 | D. | 两个反应中Fe2(SO4)3均作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com