
| A、电负性是人为规定的一个相对数值,不是绝对标准 |
| B、元素电负性的大小反映了元素对键合电子引力的大小 |
| C、元素的电负性越大,则元素的非金属性越强 |
| D、元素的电负性是元素固有的性质,与原子结构无关 |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
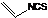 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3查看答案和解析>>
科目:高中化学 来源: 题型:
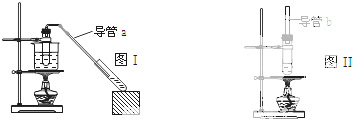
| A、制乙酸乙酯用图I装置,制乙酸丁酯用图II 装置 |
| B、导管a和导管b的作用都是冷凝回流 |
| C、都可用Na2CO3 溶液来洗去酯中的酸和醇 |
| D、加入过量的乙酸可以提高醇的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 577 | 1820 | 2740 | 11600 | 14800 | 18400 | 23400 |
| A、1 | B、3 | C、5 | D、7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BeCl2分子中各原子最外层均已满足8电子稳定结构 |
| B、第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素不一定在第ⅢA族 |
| C、构成单质分子的粒子间一定存在化学键 |
| D、含有离子键的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
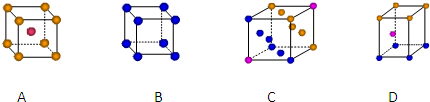
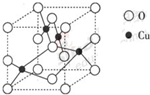
查看答案和解析>>
科目:高中化学 来源: 题型:
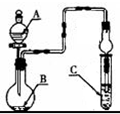
| A、若A为浓硫酸,B为铜,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为Na2O2固体,C中盛氢硫酸溶液,则C中溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
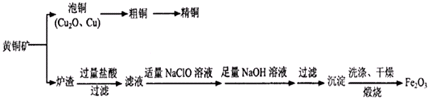
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com