
| n |
| V |
| 5.6L |
| 22.4L/mol |
| 0.48mol |
| 0.1L |
| 0.393mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、①④⑥ | B、①②③④ |
| C、④⑤⑥⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素位于第5周期,ⅢB族 |
| B、该元素原子核外有5个电子层 |
| C、该元素原子最外层共有3个电子 |
| D、该元素原子M能层共有18个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
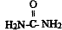 )做还原剂还原氮氧化合物是目前处理汽车尾气的一种方法,现设计实验模拟该过程并检验或收集其反应产物.
)做还原剂还原氮氧化合物是目前处理汽车尾气的一种方法,现设计实验模拟该过程并检验或收集其反应产物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加入酸性高锰酸钾溶液,后加银氨溶液,微热 |
| B、先加入溴水,后加酸性高锰酸钾溶液 |
| C、先加入新制氢氧化铜悬浊液,加热,调PH至酸性再加入溴水 |
| D、先加入银氨溶液,再另取该物质加入溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油能使溴水褪色 |
| B、皂化反应是指油脂在碱性条件下的水解过程 |
| C、硬水使肥皂的去污能力减弱是因为发生了沉淀反应 |
| D、油脂的水解反应称皂化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com