
【题目】![]() 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
化学式 |
|
| HClO |
电离平衡常数 |
|
|
|
回答下列问题:
(1)一般情况下,当温度升高时,![]() ______填“增大”、“减小”或“不变”。
______填“增大”、“减小”或“不变”。
(2)下列四种离子结合质子能力由大到小的顺序是______填序号;
a、CO32- b、ClO- c、CH3COO- d、HCO3-
(3)下列反应不能发生的是______填序号
a. ![]()
b. ![]()
c. ![]()
d. ![]()
(4)用蒸馏水稀释![]() 的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
的醋酸,下列各式表示的数值随水量的增加而增大的是______填序号;
a. 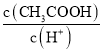 b.
b. ![]() c.
c.![]() d.
d.![]()
(5)体积均为10mLpH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。
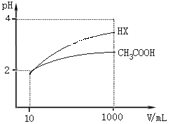
则HX的电离平衡常数______填“大于”、“等于”或“小于”,下同醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液中水电离出来的c(H+),理由是___________。
【答案】增大 ![]() cd b 大于 大于 稀释后HX溶液中的
cd b 大于 大于 稀释后HX溶液中的![]() 小于
小于![]() 溶液中的
溶液中的![]() ,它对水的电离的抑制能力减弱
,它对水的电离的抑制能力减弱
【解析】
(1)弱电解质的电离为吸热过程,升高温度,促进弱电解质的电离;
(2)电离平衡常数越大,酸越强,酸根离子对应的酸的酸性越强,酸根离子结合质子的能力越弱;
(3)根据酸性强弱,结合强酸能够制取弱酸分析判断;
(4)醋酸是弱电解质,加水稀释,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以c(CH3COO-)、c(H+)、c(CH3COOH)都减小,据此分析解答;
(5)加水稀释,促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,据此分析解答。
(1)弱电解质的电离为吸热过程,升高温度,促进弱电解质的电离,所以当温度升高时,Ka增大,故答案为:增大;
(2)电离平衡常数越大,酸越强,越易电离,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合质子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c,故答案为:a>b>d>c;
(3)酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-。a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O,碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;b.ClO-+CH3COOH═CH3COO-+HClO,CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;c.CO32-+HClO═CO2↑+H2O+ClO-,HClO的酸性小于碳酸,该反应无法发生,故c正确;d.2ClO-+CO2+H2O═CO32-+2HClO,酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;故答案为:cd;
(4)a.加水稀释,促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以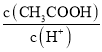 的比值减小,故a错误;b.加水稀释,促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则
的比值减小,故a错误;b.加水稀释,促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则![]() 的比值增大,故b正确;c.加水稀释,尽管促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以
的比值增大,故b正确;c.加水稀释,尽管促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以![]() 的比值减小,故c错误;d.加水稀释,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,
的比值减小,故c错误;d.加水稀释,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,![]() 的比值减小,故d错误,故答案为:b;
的比值减小,故d错误,故答案为:b;
(5)加水稀释,促进弱酸电离,pH相同的不同酸,稀释相同的倍数,pH变化大的酸,酸性强,变化小的酸,酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大,对水的电离的抑制程度越大;根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于醋酸的电离平衡常数;稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+),因为溶液中氢离子浓度越小,对的抑制程度越小,水的电离程度越大,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱,故答案为:大于;大于;稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡 H2O![]() H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO3溶液B.向水中加入 NH4Cl 溶液
C.向水中加入CH3COONa 溶液D.将水加热到 100℃,使 pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是

A. 图A装置Cu和浓硝酸制取NO B. 图B装置实验室制备Cl2
C. 图C装置实验室制取乙酸乙酯 D. 图D装置实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图,下列叙述不正确的是( )
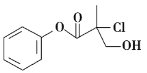
A.有机物A含有3种官能团
B.有机物A和NaOH的醇溶液共热可发生消去反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.有机物A能使溴水和酸性高锰酸钾溶液均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇和浓硫酸共热制取乙烯:![]()
![]()
![]() 。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
。某同学用如图装置进行乙烯制取实验。下列叙述不正确的是( )
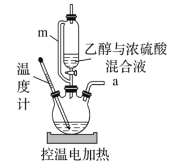
A.m的作用是确保乙醇与浓硫酸能顺利流下
B.电控温值可设置在165~175℃
C.反应混合液的加入顺序依次为乙醇、浓硫酸
D.加热时若发现三颈瓶中未加碎瓷片,应立即补加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学对![]() 、
、![]() 、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
、稀硫酸组成的原电池进行了探究,其中甲同学利用如图1所示装置进行探究,乙同学经过查阅资料后设计了图2装置进行探究(盐桥内含有某种电解质的饱和溶液,起到连通电路的作用)。
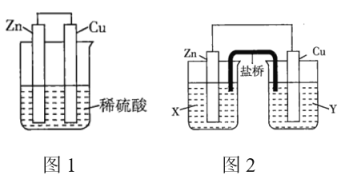
(1)实验表明,图1中铜电极上有气泡产生,说明反应中有一部分化学能转化为_______能。
(2)图2中的X、Y分别是![]() 溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
溶液、稀硫酸,实验过程中只有正极上产生气泡,则X是_______,正极上的电极反应式为_______。
(3)当图1装置中的溶液质量增加![]() 时,生成氢气_______L(标准状况);当图2中锌电极的质量减少
时,生成氢气_______L(标准状况);当图2中锌电极的质量减少![]() 时,电路中转移的电子为_______
时,电路中转移的电子为_______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol/L NaOH溶液480 mL和1.0 mol/L硫酸溶液250 mL。根据这两种溶液的配制情况回答下列问题。
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
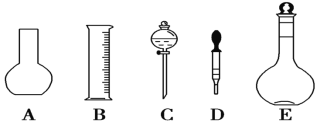
(2)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.3 mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.3 mol/L。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为_______mL(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素,请回答下列问题:
⑴基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
⑵Co能形成[Co(CNO)6]3-
①1 mol该离子中含有δ键的数目为________。
②与CNO-互为等电子体的分子为________(填化学式,任写一种)。
③相同压强下,CO晶体的熔点高于N2晶体的原因是________。
⑶氟硼酸铵(NH4BF4)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等.是合成氮化硼纳米管的原料之一。
①1 mol NH4BF4含有_______ mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为________(用元素符号表示)。
③BF4-的空间立体构型为________,其中硼原子的杂化轨道类型为________。
④BN晶体有多种结构,其中六方相氮化硼![]() 如图甲
如图甲![]() 是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
是通常存在的稳定相,其结构与石墨相似却不导电,原因是_______,而立方氮化硼具有金刚石型结构,其晶胞如图乙所示,若晶胞参数为a pm,晶胞密度为d gcm-3,则阿伏加德罗常数的值可表示为________mol-1。
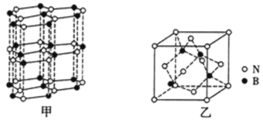
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)钠元素的焰色反应呈黄色,其中黄色对应的辐射波长为______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)C、H、N、O四种元素中电负性最大的是______![]() 填元素符号
填元素符号![]() ,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
,写出Fe2+的最外层电子排布式______。根据等电子原理,写出CN-的电子式______,CNO-中心原子的杂化方式为______。
(3)![]() 的沸点比
的沸点比![]() ______
______![]() 填“高”或“低”
填“高”或“低”![]() ;原因是______。
;原因是______。
(4)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为______nm;MnO也属于NaCl型结构,晶胞参数为a’=0.448nm,则r(Mn2+)为______nm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com