
| A.1∶1混合的Pb3O4、PbO |
| B.1∶2混合的PbO2、Pb3O4 |
| C.1∶4∶1混合的PbO2、Pb3O4、PbO |
| D.4∶1∶1混合的PbO2、Pb3O4、PbO |


科目:高中化学 来源:不详 题型:填空题

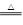 CeO2·8OH + 8_____↑;CeO2·8OH
CeO2·8OH + 8_____↑;CeO2·8OH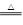 CeO2+ 4H2O↑+2O2↑。
CeO2+ 4H2O↑+2O2↑。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在潮湿的空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2 K2S + K2SO3 + 3 H2O
2 K2S + K2SO3 + 3 H2O| A.a = 2b | B.x = 2 | C.n = 0.48 | D.b = 0.02 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.20 | B.2.33 | C.2.00 | D.0.50 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.消耗硫酸亚铁铵的物的质量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质量为 mol mol |
| C.反应中发生转移的电子数为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.每生成55 g K2S转移电子数为6.02×1023 |
| B.S和KNO3均为还原剂 |
| C.反应过程中氮元素被还原 |
| D.CO2为还原产物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18.0 L | B.27.0 L | C.31.4L | D.33.6 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com