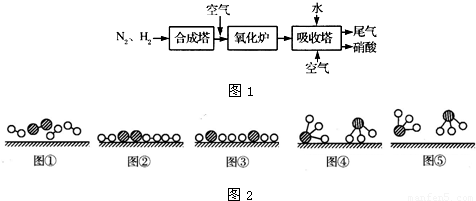
解:(1)、分析题中图可以知道,图②表示N
2、H
2被吸附在催化剂表面,而图③表示在催化剂表面,N
2、H
2中化学键断裂,故答案为:图②表示N
2、H
2被吸附在催化剂表面,图③表示在催化剂表面,N
2、H
2中化学键断裂;
(2)、化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、
离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.根据以上概念可以写出该反应的化学平衡常数表达式 K=
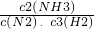
,有反应方程式:N
2(g)+3H
2(g)?2NH
3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H
2 和N
2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,则参加反应的氮气的物质的量为x/3mol,生成的氨气为2x/3mol,列式:
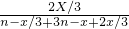
=15%,解得x≈0.78nmol,H
2 的转化率为:0.78nmol÷3nmol×100%=26%,
故答案为:K=
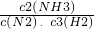
; 26%;
(3)、已知:4NH
3(g)+3O
2(g)=2N
2(g)+6H
2O(g)△H=-1 266.8kJ/mol ①
N
2(g)+O
2(g)=2NO(g)△H=+1 80.5kJ/mol ②
①+②×2得:4NH
3(g)+5O
2(g)=4NO(g)+6H
2O(g)△H=-905.8kJ/mol
故答案为:4NH
3(g)+5O
2(g)=4NO(g)+6H
2O(g)△H=-905.8kJ/mol;
(4)、不断通入空气,提供充足的氧气,以便使NO循环利用,全部转化成硝酸.
故答案为:使NO循环利用,全部转化成硝酸.
分析:(1)、图②是表示N
2、H
2被吸附在催化剂的表面;图③则表示在催化剂表面,N
2、H
2中的化学键断裂;
(2)、①化学平衡常数是:在特定物理条件下(如温度、压力、溶剂性质、
离子强度等),可逆化学反应达到平衡状态时生成物与反应物的浓度比或反应物与反应产物的浓度比.用符号“K”表示;
②根据反应方程式 N
2(g)+3H
2(g)?2NH
3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H
2 和N
2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,列式求算即可;
(3)、利用盖斯定律,把第二个热化学方程式两边扩大2倍,然后两个方程式相加就可以得到氨催化氧化的热化学方程式;
(4)、通入空气,提供充足的氧气,以便使NO能够循环利用,全部转化成硝酸.
点评:本题以硝酸的工业制备为背景,综合考查对化学反应中化学键变化、热化学方程式、化学平衡常数、转化率计算等考点以及对图形的观察能力、推理能力.

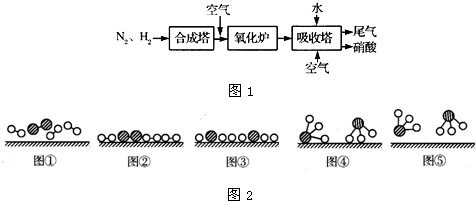
 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______.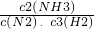 ,有反应方程式:N2(g)+3H2(g)?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,则参加反应的氮气的物质的量为x/3mol,生成的氨气为2x/3mol,列式:
,有反应方程式:N2(g)+3H2(g)?2NH3(g),设参加反应的氢气的物质的量xmol,原混合气体中 H2 和N2 按3:1(体积之比)混合,物质的量之比也是3:1,设氢气3nmol,氮气nmol,则参加反应的氮气的物质的量为x/3mol,生成的氨气为2x/3mol,列式: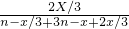 =15%,解得x≈0.78nmol,H2 的转化率为:0.78nmol÷3nmol×100%=26%,
=15%,解得x≈0.78nmol,H2 的转化率为:0.78nmol÷3nmol×100%=26%,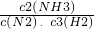 ; 26%;
; 26%;

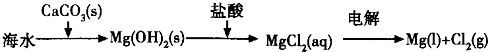
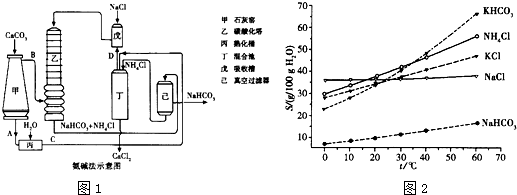

 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是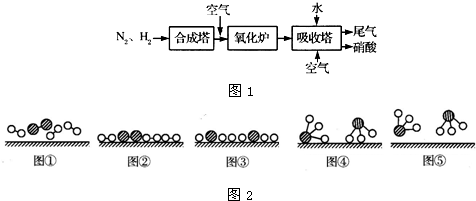
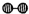
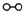

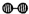 、
、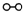 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是______.