
| 时间/min SO3/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
分析 (1)I、CaCO3 (s)?CO2 (g)+CaO(s)△H=+178kJ/mol
Ⅱ、SO2(g)+CaO(s)?CaSO2(s)△H=-402kJ/mol
Ⅲ、2CaS02(s)+02(g)+4H2O(l)=2[CaS04•2H2O](s)△H=-234.2kJ/mol.
石灰石、二氧化硫、氯气和水反应生成生石膏的反应等于Ⅰ×2+Ⅱ×2+Ⅲ得到,根据盖斯定律计算;
(2)A容器保持恒温恒压,B容器保持恒温恒容,C容器保持恒容絶热,
a.根据平衡的移动方向判断3个容器中SO2的平衡转化率的大小顺序;
b.A容器内气体的平均摩尔质量等于质量和物质的量的比值,变量不变的状态是平衡状态;
c.A、B两个容器达到平衡所用的时间和反应速率有关;
d.平衡常数和温度有关,平衡常数不变不能确定是平衡状态;
(3)①在T1温度下,计算20-40min内SO2的反应速率v(SO2)=$\frac{△c}{△t}$;
②因为该反应为放热反应,升高温度,平衡逆向移动,二氧化硫的含量增大;
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度等于原平衡时SO2的浓度,温度不变,平衡常数不变.
解答 解:(1)I、CaCO3 (s)?CO2 (g)+CaO(s)△H=+178kJ/mol
Ⅱ、SO2(g)+CaO(s)?CaSO2(s)△H=-402kJ/mol
Ⅲ、2CaS03(s)+02(g)+4H2O(l)=2[CaS04•2H2O](s)△H=-234.2kJ/mol,石灰石、二氧化硫、氯气和水反应生成生石膏的反应2SO2(g)+2CaS03(S)+02(g)+4H2O(l)=2[CaS04•2H2O](S)等于Ⅰ×2+Ⅱ×2+Ⅲ得到,根据盖斯定律,焓变=2×178kJ/mol+2(-402kJ/mol)-234.2kJ/mol=-681.8kJ/mol,
故答案为:2SO2(g)+2CaS03(s)+02(g)+4H2O(l)=2[CaS04•2H2O](s)△H=-681.8kJ/mol;
(2)a、对于A容器,该反应是一个气体体积缩小的反应,随着反应进行气体体积减小,但要保持恒压,必须压缩体积,相当与增大压强,二氧化硫的转化率增大,B容器为恒容,随着反应的进行,气体体积缩小,二氧化硫转化率相对A要小,C容器恒温绝热,该反应为放热反应,温度升高,速率加快,平衡逆向移动,相对B二氧化硫的转化率会小,故a正确;
b、气体质量和物质的量均在发生改变,平均摩尔质量不是变量,不能判断平衡,故b错误;
c、A容器压强比B大,故反应速率快,达到平衡所需的时间A比B短,故C错误;
d、平衡常数只是温度的函数,温度不变,平衡常数不变,平衡,故d正确;
故答案为:ad;
(3)①在T1温度下,计算20-40min内SO2的反应速率v(SO2)=[(1052-540)×10-3]÷64÷20÷20=2×10-5mol/(L•min),故答案为:2×10-5;
②因为该反应为放热反应,升高温度,平衡逆向移动,二氧化硫的含量增大,结合表格数据,T2时的含量比T1时低,若其它条件都相同,则T1<T2;根据数据的递变规律,x>0.06,故答案为:<;>;
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度等于原平衡时SO2的浓度,因为该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等,故答案为:=;该反应的平衡常数表达式为k=1/c(SO2),温度不变,平衡常数不变,所以浓度相等.
点评 本题考查化学反应的速率、化学平衡常数表达式、化学平衡的移动和反应的自发性等,题目难度中等,注意相关知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:选择题
青蒿酸的结构简式如图所示。下列有关说法正确的是( )
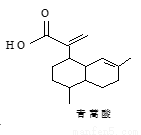
A.青蒿酸的分子式为C15H20O2
B.1mol青蒿酸最多可与3molH2加成
C.青蒿酸与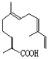 互为同分异构体
互为同分异构体
D.苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
在100 ℃时,3.88 g 的气体A与足量的Na2O2反应,可放出氧气,且固体的质量增加了2.28 g,由此可知,A的组成为( )
A.只有水蒸气 B.只有二氧化碳 C.水蒸气和二氧化碳 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
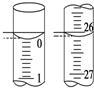 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯化反应也属于加成反应 | |
| B. | 酯化反应中酸脱去羟基,醇脱去氢原子 | |
| C. | 浓硫酸在酯化反应中只起催化剂的作用 | |
| D. | 乙酸乙酯的结构简式为CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
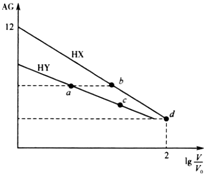 常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | a、b溶液中导电离子数目相等 | |
| B. | 水的电离程度:a<b<c | |
| C. | d点所示溶液的AG=8 | |
| D. | 与等浓度的NaOH溶液中和时,c点消耗NaOH溶液的体积大于a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
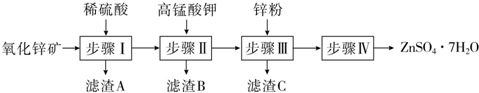
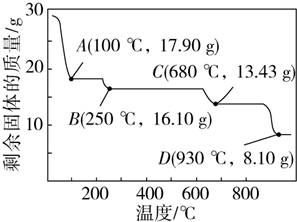
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com