
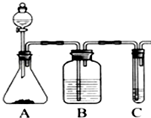
 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.分析 利用强酸制取弱酸原理回答,醋酸的酸性强于碳酸,故装置A中是碳酸钠固体,分液漏斗中是醋酸溶液,利用B装置除去挥发出来的乙酸,然后在C中盛放苯酚钠溶液即可验证,以此来解答.
解答 解:(1)由图可知,发生强酸制取弱酸的反应,A中固体为碳酸钠,分液漏斗中为醋酸,B为碳酸氢钠,用于除去挥发的醋酸,C中为苯酚钠,故答案为:d;b;c;
(2)苯酚钠与碳酸反应生成苯酚和碳酸氢钠,离子反应方程式为C6H5O-+CO2+H2O→C6H5OH+HCO3-,
故答案为:C6H5O-+CO2+H2O→C6H5OH+HCO3-;
(3)由于醋酸具有挥发性,若不除去挥发出来的醋酸,会对后续实验造成干扰,故答案为:不合理,乙酸有挥发性且能和苯酚钠反应,干扰CO2与苯酚钠的反应,
故答案为:不合理,乙酸有挥发性且能和苯酚钠反应,干扰CO2与苯酚钠的反应.
点评 本题考查性质实验设计及实验装置综合应用,为高频考点,把握强酸制取弱酸的反应原理及装置B的作用为解答的关键,侧重分析与实验能力的考查,注意醋酸易挥发,题目难度不大.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
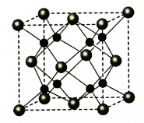
| A. | K3C60的摩尔质量是837 | |
| B. | 1 mol K3C60中含有的离子数目为63×6.02×1023 | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式可写为KC20 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
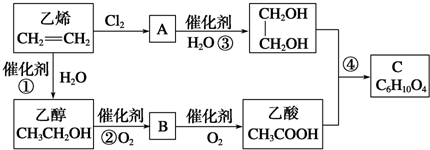
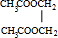 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 | |
| B. | 湿法中FeO42-是氧化产物;干法中O2也是氧化产物 | |
| C. | 干法中每生成1mol Na2FeO4,这个反应共转移4mol电子 | |
| D. | 高铁酸钠中铁显+6价,它在氧化还原反应中通常被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了提高汽油的产量和质量 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主要得到的是乙烯、丙烯等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式为-COH | |
| B. | 乙烯和乙醇都能使溴水和酸性KMnO4溶液褪色 | |
| C. | 乙酸乙酯中的官能团为酯基(-COO-),能发生水解反应 | |
| D. | 苯能与氢气发生加成反应,是因为苯分子中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
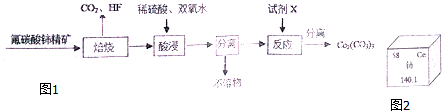
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
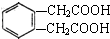 ;
;
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com