
| A. | 乙苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 糖、油脂、蛋白质都能发生水解反应 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
分析 A.含有碳碳不饱和键、醛基的有机物及连接苯环碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化;
B.单糖不能发生水解反应;
C.甲醛能和苯酚发生缩聚反应、乙二醇能和二元羧酸发生缩聚反应;
D.烷烃中含有几种氢原子其一氯代物就有几种.
解答 解:A.含有碳碳不饱和键、醛基的有机物及连接苯环碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化,环己烯含有碳碳双键,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙苯中连接苯环的碳原子上含有氢原子,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故A正确;
B.单糖不能发生水解反应,如葡萄糖和果糖,故B错误;
C.甲醛能和苯酚发生缩聚反应、乙二醇能和二元羧酸发生缩聚反应,所以甲醛和乙二醇都可作为合成高分子化合物的单体,故C正确;
D.烷烃中含有几种氢原子其一氯代物就有几种,丙烷、2-甲基丙烷都含有两种氢原子,所以丙烷和2-甲基丙烷的一氯代物均为两种,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查不饱和烃、同分异构体等知识点,注意:并不是所有的苯的同系物都能被酸性高锰酸钾溶液氧化,为易错点.


科目:高中化学 来源: 题型:解答题
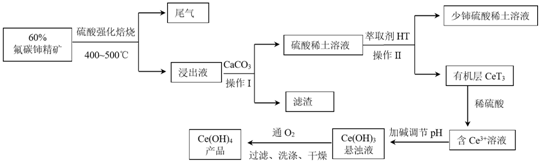
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
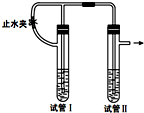 在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.
在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
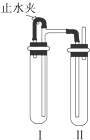 用下面两种方法均可制得Fe(OH)2白色沉淀.
用下面两种方法均可制得Fe(OH)2白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氡气在标准状况下密度约是19.8g•L-1 | |
| B. | 氡气化学性质较活泼,因此对人体有害 | |
| C. | “锕射气”是氡的同位素 | |
| D. | 氡原子核外有7个电子层,最外层有8个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com