
| A. | 加入NH4HSO4固体,v(H2)不变 | B. | 加入少量水,v(H2)减小 | ||
| C. | 加入CH3COONa固体,v(H2)减小 | D. | 滴加少量CuSO4溶液,v(H2)加快 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 状态 | 物质 | 密度 | 1mol该物质的质量 | 1mol该物质的体积 | 结论 |
| 固态 | Fe | 7.86g•cm-3(20℃) | 55.96g | 7.12 cm3 | |
| Al | 2.70g•cm-3(20℃) | 27g | 10.00cm3 | ||
| 液体 | H2O | 0.998g•cm-3(20℃) | 18g | 18.04cm3 | |
| H2SO4 | 1.83g•cm-3(20℃) | 98.00g | 53.55cm3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$
 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
 .
. .
. .
. 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线
的合成路线 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{△}{→}$
$\stackrel{△}{→}$
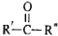 →
→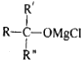 $\stackrel{H_{2}O}{→}$
$\stackrel{H_{2}O}{→}$


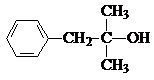


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 制备乙烯时向乙醇和浓硫酸的混合液中加入碎瓷片 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 用试管加热碳酸氢钠固体时使试管口竖直向上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,W与R以1:3的原子个数比形成的化合物的电子式
,W与R以1:3的原子个数比形成的化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸,Na2CO3溶液 | B. | 稀H2SO4溶液,NaAlO2溶液 | ||
| C. | Cl2,NaBr溶液 | D. | CO2,澄清石灰水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com