
【题目】室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是
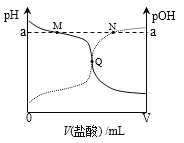
A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中溶质一定含NH4Cl,可能还含HCl
C. Q点消耗盐酸的体积等于氨水的体积
D. Q点所示溶液中c(NH4+)> c(Cl-)> c(NH3·H2O)> c(OH-)> c(H+)
科目:高中化学 来源: 题型:
【题目】以下物质间的转化通过一步反应不能实现的是( )
A.HCl →Cl2→HClO→NaClO
B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Al→NaAlO2 →Al(OH)3→Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向KBr和KI的混合溶液中通入足量的氯气后,再将溶液蒸干灼烧,最后剩余的固体物质是( )
A. KCl和KBr B. KCl C. KCl和I2 D. KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
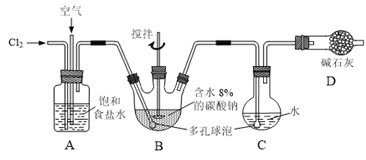
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用酒精常用淀粉发酵法制备,下列说法正确的是
A. 淀粉和酒精均属于化合物
B. 淀粉溶液和酒精溶液均能产生丁达尔效应
C. 淀粉和酒精可用碘水鉴别
D. 淀粉转化为酒精不属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅱ]丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=242 kJ·mol1
O2(g)= H2O(g) ΔH3=242 kJ·mol1
反应①的ΔH1为________kJ·mol1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
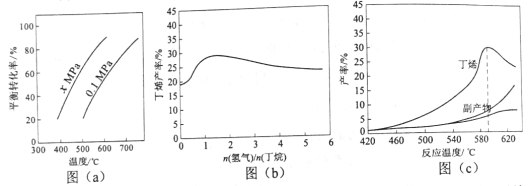
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__________________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是( )
A. 微粒半径:Mg2+>F- B. 稳定性:HI>HBr
C. 熔点:Al>Na D. 酸性:H2SO4>HClO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com