
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×éµÄĶ¬Ń§ÄāĄūÓƵā»ÆŃĒĢśÓėĢ¼ĖįĒāÄʵķ“Ó¦Ą“Öʱøøß“æ¶ČµÄµā»ÆÄĘ¾§Ģ壮»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µā»ÆŃĒĢśČÜŅŗµÄÖʱø£ŗ½«µāŗĶĢś·Ū°“ĪļÖŹµÄĮæÖ®±ČŌŚ ![]() ©
© ![]() Ö®¼äÅäĮĻ£¬¼ÓČėČż¾±ÉÕĘæÖŠ£ØČēĶ¼£©£¬Č»ŗó¼ÓČėŹŹĮæĖ®£¬²¢Ļņ×°ÖĆÖŠ³ÖŠųĶØČėN2 £¬ ŌŚ40©60”ęĻĀ½Į°č·“Ó¦30©50min£¬“ż·“Ó¦Ķź³É¼ģŃé³ö·“Ó¦ŅŗÖŠ²»ŗ¬µāµ„ÖŹŗ󣬹żĀĖ¼“ÖʵƵā»ÆŃĒĢśČÜŅŗ£® ¢ŁÅäĮĻÖŠĢś·Ū¹żĮæµÄÄæµÄŹĒ£»³ÖŠųĶØČėN2µÄÄæµÄŹĒ £®
Ö®¼äÅäĮĻ£¬¼ÓČėČż¾±ÉÕĘæÖŠ£ØČēĶ¼£©£¬Č»ŗó¼ÓČėŹŹĮæĖ®£¬²¢Ļņ×°ÖĆÖŠ³ÖŠųĶØČėN2 £¬ ŌŚ40©60”ęĻĀ½Į°č·“Ó¦30©50min£¬“ż·“Ó¦Ķź³É¼ģŃé³ö·“Ó¦ŅŗÖŠ²»ŗ¬µāµ„ÖŹŗ󣬹żĀĖ¼“ÖʵƵā»ÆŃĒĢśČÜŅŗ£® ¢ŁÅäĮĻÖŠĢś·Ū¹żĮæµÄÄæµÄŹĒ£»³ÖŠųĶØČėN2µÄÄæµÄŹĒ £®
¢Ś¼ģŃé·“Ó¦ŅŗÖŠ²»ŗ¬µāµ„ÖŹµÄ·½·ØŹĒ £®
£Ø2£©µā»ÆÄĘČÜŅŗµÄÖʱø£ŗ½«ÖʱøŗƵĵā»ÆŃĒĢśČÜŅŗ¼ÓČėĢ¼ĖįĒāÄĘČÜŅŗÖŠ£¬æŲÖʵā»ÆŃĒĢśÓėĢ¼ĖįĒāÄʵÄĪļÖŹµÄĮæÖ®±ČŌŚ ![]() ”×
”× ![]() £¬ŌŚ80©100”ęĻĀ£¬·“Ó¦30©50min£¬·“Ӧɜ³Éµā»ÆÄĘ¼°ĮņĖįŃĒĢśµČ£®øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
£¬ŌŚ80©100”ęĻĀ£¬·“Ó¦30©50min£¬·“Ӧɜ³Éµā»ÆÄĘ¼°ĮņĖįŃĒĢśµČ£®øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø3£©µć»ÆÄʵÄĢį“æÓė½į¾§£ŗ ¢Ł³żČ„µā»ÆÄĘČÜŅŗÖŠŅŌHCO3©µÄ·½·ØŹĒ £®
¢Ś“Óµā»ÆÄĘČÜŅŗÖŠ»ńµĆµā»ÆÄĘ¾§Ģå£Ø20”ꏱČܽā¶ČĪŖ179/100gĖ®£¬100”ꏱČܽā¶ČĪŖ302/100gĖ®£©µÄ²Ł×÷·½·ØŹĒ £®
£Ø4£©µā»ÆÄʵÄĢį¶ČµÄ²ā¶Ø£ŗ øĆŠ”×éĶ¬Ń§³ĘČ”ÖʵƵĵā»ÆÄĘ¾§Ģå18.1g£¬ČÜÓŚĖ®ŗó¼ÓČė50mL2.5mol/LAgNO3ČÜŅŗ£¬¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬³ĘµĆ³ĮµķµÄÖŹĮæĪŖ28.2g£®Ōņµā»ÆÄĘ¾§ĢåµÄ“æ¶ČĪŖ £® £ØŌÓÖŹ²»²ĪÓė·“Ó¦£¬½į¹ū±£ĮōÖĮŠ”ŹżµćŗóĮ½Ī»£©
”¾“š°ø”æ
£Ø1£©Ź¹µā³ä·Ö·“Ó¦ŅŌĢįøßĘäĄūÓĆĀŹ£»·ĄÖ¹Éś³ÉµÄI©±»Ńõ»Æ£»Č”ÉŁĮæČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČĖµķ·ŪČÜŅŗ£Ø¼°ÉŁĮæĻ”ĮņĖį£©£¬ČÜŅŗ²»±äĄ¶É«£¬ĖµĆ÷ŅŃ²»ŗ¬I2
£Ø2£©FeI2+2NaHCO3=FeCO3”ż+2NaI+CO2”ü+H2O
£Ø3£©Ļņ£Ø2£©µÄĀĖŅŗÖŠ¼ÓČėÉŌ¹żĮæµÄHIČÜŅŗ£¬ŌŁĪ¢ČČ£»Õō·¢ÅØĖõÖĮ±ķĆę³öĻÖ¾§Ä¤£¬ĄäČ“½į¾§²¢øÉŌļ
£Ø4£©99.45%
”¾½āĪö”æ½ā£ŗ£Ø1£©¢ŁÖʱøµā»ÆŃĒĢśČÜŅŗ£¬ĪŖ±£Ö¤µā³ä·Ö·“Ó¦£¬Ģś·Ū¹żĮ棬·“Ó¦¹ż³ĢĶØČėµŖĘų£¬·ĄÖ¹·ĄÖ¹Éś³ÉµÄI©±»Ńõ»Æ£» ĖłŅŌ“š°øŹĒ£ŗŹ¹µā³ä·Ö·“Ó¦ŅŌĢįøßĘäĄūÓĆĀŹ£»·ĄÖ¹Éś³ÉµÄI©±»Ńõ»Æ£»
¢Ś¼ģŃé·“Ó¦ŅŗÖŠ²»ŗ¬µāµ„ÖŹæÉŃ”µķ·Ū£¬¹Ź·½·ØŹĒ£ŗȔɣĮæČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČĖµķ·ŪČÜŅŗ£Ø¼°ÉŁĮæĻ”ĮņĖį£©£¬ČÜŅŗ²»±äĄ¶É«£¬ĖµĆ÷ŅŃ²»ŗ¬I2£»
ĖłŅŌ“š°øŹĒ£ŗȔɣĮæČÜŅŗÓŚŹŌ¹ÜÖŠ£¬¼ÓČĖµķ·ŪČÜŅŗ£Ø¼°ÉŁĮæĻ”ĮņĖį£©£¬ČÜŅŗ²»±äĄ¶É«£¬ĖµĆ÷ŅŃ²»ŗ¬I2£»£Ø2£©½«ÖʱøŗƵĵā»ÆŃĒĢśČÜŅŗ¼ÓČėĢ¼ĖįĒāÄĘČÜŅŗÖŠ£¬ŌŚ80©100”ęĻĀ£¬Éś³Éµā»ÆÄĘ¼°Ģ¼ĖįŃĒĢśŗĶ¶žŃõ»ÆĢ¼£¬»Æѧ·½³ĢŹ½ĪŖ£ŗFeI2+2NaHCO3=FeCO3”ż+2NaI+CO2”ü+H2O£»
ĖłŅŌ“š°øŹĒ£ŗFeI2+2NaHCO3=FeCO3”ż+2NaI+CO2”ü+H2O£»£Ø3£©¢Ł³żČ„µā»ÆÄĘČÜŅŗÖŠµÄHCO3©æÉŹŹµ±ŌöĒæČÜŅŗĖįŠŌ£¬Ķ¬Ź±×¢Ņā²»ŅżČėŌÓÖŹ£¬·½·ØĪŖ£ŗĻņ£Ø2£©µÄĀĖŅŗÖŠ¼ÓČėÉŌ¹żĮæµÄHIČÜŅŗ£¬ŌŁĪ¢ČČ£»
ĖłŅŌ“š°øŹĒ£ŗĻņ£Ø2£©µÄĀĖŅŗÖŠ¼ÓČėÉŌ¹żĮæµÄHIČÜŅŗ£¬ŌŁĪ¢ČČ£»¢Śµā»ÆÄĘ20”ꏱČܽā¶ČĪŖ179/100gĖ®£¬100”ꏱČܽā¶ČĪŖ302/100gĖ®£¬½«µā»ÆÄĘČÜŅŗÕō·¢ÅØĖõÖĮ±ķĆę³öĻÖ¾§Ä¤£¬ĄäČ“½į¾§²¢øÉŌļ£»
ĖłŅŌ“š°øŹĒ£ŗÕō·¢ÅØĖõÖĮ±ķĆę³öĻÖ¾§Ä¤£¬ĄäČ“½į¾§²¢øÉŌļ£»£Ø4£©øł¾ŻNaI”«AgI£¬Ōņm£ØNaI£©= ![]() g=18g£¬¹Ź“æ¶ČĪŖ£ŗ
g=18g£¬¹Ź“æ¶ČĪŖ£ŗ ![]() =99.45%£¬
=99.45%£¬
ĖłŅŌ“š°øŹĒ£ŗ99.45%£®


 ÖĒÄÜѵĮ·Į·²āæ¼ĻµĮŠ“š°ø
ÖĒÄÜѵĮ·Į·²āæ¼ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ2LĆܱÕČŻĘ÷ÄŚ£¬800”ꏱ·“Ó¦£ŗ2NO£Øg£©+O2£Øg£©2NO2£Øg£©ĢåĻµÖŠ£¬n£ØNO£©Ėꏱ¼äµÄ±ä»ÆČē±ķ£ŗ
Ź±¼ä£Øs£© | 0 | 1 | 2 | 3 | 4 |
n£ØNO£©£Ømol£© | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
£Ø1£©Š“³öøĆ·“Ó¦µÄĘ½ŗā³£Źż±ķ“ļŹ½£ŗK=£»ČōĘäĖūĢõ¼ž²»±ä£¬ČŻĘ÷Ģå»żĖõŠ”ĪŖ1L£¬ŌņKÖµ £® £ØŌö“󔢼õŠ”»ņ²»±ä£©£»ČōK300”ćC£¾K350”ćC £¬ ŌņøĆ·“Ó¦ŹĒČČ·“Ó¦£®
£Ø2£©ÓĆO2±ķŹ¾“Ó0”«2sÄŚøĆ·“Ó¦µÄĘ½¾łĖŁĀŹv=£»
£Ø3£©ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ
a£®v£ØNO2£©=2v£ØO2£©
b£®ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä
c£®vÄę£ØNO£©=2vÕż£ØO2£©
d£®ČŻĘ÷ÄŚĆܶȱ£³Ö²»±ä
£Ø4£©ĪŖŹ¹øĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹŌö“ó£¬ĒŅĘ½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶ÆµÄŹĒ
a£®¼°Ź±·ÖĄė³żNO2ĘųĢå
b£®ŹŹµ±ÉżøßĪĀ¶Č
c£®Ōö“óO2µÄÅضČ
d£®Ń”Ōńøߊ§“߻ƼĮ£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒāĘųµÄÖĘČ””¢“¢“ęŗĶĄūÓĆŅ»Ö±ŹĒ»ÆѧĮģÓņŃŠ¾æµÄČČµć£®H2OČČ·Ö½āæÉŅŌµĆµ½H2ŗĶO2 £¬ øßĪĀĻĀĖ®·Ö½āĢåĻµÖŠÖ÷ŅŖĘųĢåµÄĢå»ż·ÖŹżÓėĪĀ¶ČµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø £© 
A.Ķ¼ÖŠA£¬B±ķŹ¾µÄĮ£×ÓŅĄ“ĪŹĒOŗĶH
B.Ķ¼ÖŠA£¬B±ķŹ¾µÄĮ£×ÓŅĄ“ĪŹĒH+ŗĶO2©
C.Ķ¼ÖŠA£¬BÖŲŠĀÉś³ÉĖ®Ź±µÄ»ī»ÆÄܵČÓŚ0
D.Ķ¼ÖŠA£¬BÖŲŠĀÉś³ÉĖ®Ź±µÄ»ī»ÆÄÜ“óÓŚ0
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A. ÕįĢĒ”¢¹ūĢĒŗĶĀóŃæĢĒ¾łĪŖĖ«ĢĒ
B. Ö²ĪļÓĶÓ²»Æ¹ż³ĢÖŠ·¢ÉśĮĖ¼Ó³É·“Ó¦
C. ¼ÓČČÄÜɱĖĄĮ÷øŠ²”¶¾ŹĒŅņĪŖµ°°×ÖŹŹÜČȱäŠŌ
D. ¼Ó¹¤ŗó¾ßÓŠĪüĖ®ŠŌµÄÖ²ĪļĻĖĪ¬æÉÓĆ×÷Ź³Ę·øÉŌļ¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹŅ»¶ØŹōÓŚ“æ¾»ĪļµÄŹĒ£Ø””””£©
A. C3H6B. C2H6OC. CHCl3D. C2H4Cl2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĄØŗÅÄŚĪļÖŹĪŖŌÓÖŹ£¬ĻĀĮŠ³żČ„ŌÓÖŹµÄ·½·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
A. ŅŅĖįŅŅõ„£ØŅŅĖį£©£ŗÓĆNaOHČÜŅŗĻ“µÓŗó·ÖŅŗ
B. ŅŅĶé£ØŅŅĻ©£©£ŗÓĆäåĖ®Ļ“Ęų
C. äå±½£Øä壩£ŗÓĆNaOHČÜŅŗĻ“µÓŗó·ÖŅŗ
D. ŅŅ“¼£ØĖ®£©£ŗĻČ¼ÓÉśŹÆ»ŅŗóÕōĮó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ¢Ł¢Ś¢ŪČżĘæĢå»żĻąµČ£¬ÅØ¶Č¶¼ŹĒ1molL©1µÄHClČÜŅŗ£¬½«¢Ł¼ÓČČÕō·¢ÖĮĢå»ż¼õÉŁŅ»°ė£¬ŌŚ¢ŚÖŠ¼ÓČėÉŁĮæCH3COONa¹ĢĢ壬£Ø¼ÓČėŗóČÜŅŗČŌ³ŹĒæĖįŠŌ£©£¬¢Ū²»×÷øÄ±ä£¬Č»ŗóŅŌ·ÓĢŖ×÷ÖøŹ¾¼Į£¬ÓĆNaOHČÜŅŗµĪ¶ØÉĻŹöČżÖÖČÜŅŗ£¬ĖłĻūŗĵÄNaOHČÜŅŗĢå»żŹĒ£Ø £©
A.¢Ł=¢Ū£¾¢Ś
B.¢Ū£¾¢Ś£¾¢Ł
C.¢Ū=¢Ś£¾¢Ł
D.¢Ł=¢Ś=¢Ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦A£Øs£©+B£Øg£©C£Øg£©+D£Øg£©µÄ»ÆŃ§Ę½ŗā³£ŹżŗĶĪĀ¶ČµÄ¹ŲĻµČē±ķ£ŗ
ĪĀ¶Č/”ę | 700 | 800 | 830 | 1 000 | 1 200 |
»ÆŃ§Ę½ŗā³£Źż | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.øĆ·“Ó¦ĪŖĪüČČ·“Ó¦
B.øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ĪŖK= ![]()
C.ĘäĖūĢõ¼ž²»±äŹ±£¬Ōö“óĢåĻµµÄŃ¹Ē棬»ÆŃ§Ę½ŗā³£Źż¼õŠ”
D.µ„Ī»Ź±¼äÄŚÉś³ÉBŗĶDµÄĪļÖŹµÄĮæĻąµČŹ±£¬øĆ·“Ó¦“¦ÓŚĘ½ŗāדĢ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻÓĆĀĮĶĮæó£ØÖ÷ŅŖ³É·ÖĪŖAl2O3£¬ŗ¬Fe2O3ŌÓÖŹ£©ĪŖŌĮĻŅ±Į¶ĀĮµÄ¹¤ŅÕĮ÷³ĢČēĻĀ£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø”” ””£©
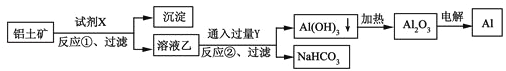
A. ŹŌ¼ĮXĒāŃõ»ÆÄĘČÜŅŗ
B. ·“Ó¦¢Ł”¢¹żĀĖŗóĖłµĆ³ĮµķĪŖŗģŗÖÉ«Fe2O3
C. Ķ¼ÖŠĖłŹ¾×Ŗ»Æ·“Ó¦¶¼²»ŹĒŃõ»Æ»¹Ō·“Ó¦
D. ·“Ó¦¢ŚµÄ»Æѧ·½³ĢŹ½ĪŖ2NaAlO2+CO2+3H2O=2Al£ØOH£©3”ż+Na2CO3
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com