
| A. | 前者大 | B. | 相等 | C. | 后者大 | D. | 不能肯定 |
科目:高中化学 来源: 题型:选择题
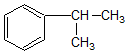
| A. | 它不能使溴水褪色也不能使酸性KMnO4溶液褪色 | |
| B. | 在FeBr3作催化剂时与Br2发生取代反应 | |
| C. | 在一定条件下可发生加成反应 | |
| D. | 一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内气体颜色变浅,平均相对分子质量不变 | |
| B. | 平衡不移动,混合气体密度增大 | |
| C. | H2的转化率增大,HI平衡浓度变小 | |
| D. | 改变条件前后,速率图象如图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,当阴极析出32g铜时,转移电子数小于NA | |
| B. | 常温下,1.0L 1.0 mol/LNaAlO2溶液中含有的氧原子数为2NA | |
| C. | 等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 | |
| D. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1 mol氧原子,则三种气体的物质的量之比为( )
A.1:1:1 B.1:2:3 C.3:2:1 D.6:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com