
| A、200mL 1mol/L的NaCl溶液中阴阳离子总数为0.2NA |
| B、标准状况下,11.2L乙醇中的分子数为0.5NA |
| C、58.5gNaCl完全溶于2L水中,得到NaCl溶液的物质的量浓度为0.5mol/L |
| D、1mol金属Na与足量的O2反应生成Na2O和Na2O2混合物,Na失去的电子数为NA |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
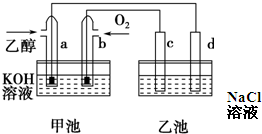
| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比为2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、按照树状分类法的分类原则,NF3属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO的摩尔质量是28 g |
| B、常温常压下,1 mol N2的体积是22.4 L |
| C、18gH2O含有的氢原子总数为2×6.02×1023 |
| D、0.1 mol/L Na2SO4溶液中,Na+的物质的量浓度为 0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为114.6 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3=Na22++CO32- |
| B、Na2SO4=2Na++SO42- |
| C、NaHCO3=Na++H++CO32- |
| D、NaOH=Na++H++O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe能溶于FeCl3溶液:Fe+Fe3+═2Fe2+ |
| B、Cl2的氧化性强于Br2:Cl2+2Br-═2Cl-+Br2 |
| C、Na与H2O反应产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
| D、Na2SiO3溶液与盐酸反应生成硅酸凝胶:SiO32-+2H+═H2SiO3(胶体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水常温下呈液态,冰浮在水上,均与氢键有关 | ||||
| B、用于航天工业的氢氧燃料电池的电解质,使用H2SO4的效果比KOH好 | ||||
| C、SO2、氮氧化物和可吸处颗粒物是造成雾霾的一个重要原因 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com