
����Ŀ��1��76��ͭþ�Ͻ���ȫ�ܽ���50mL���ܶ�Ϊ1��40g/cm3����������Ϊ63%��Ũ�����У��õ�NO2����1792mL ����״��������Ӧ�����Һ�м���������1��0mol/LNaOH��Һ��ǡʹ��Һ�еĽ�������ȫ������������˵������ȷ����
A. ��Ũ������HNO3�����ʵ���Ũ����14��0mol/L
B. ����NaOH��Һ�������50mL
C. Ũ��������Ͻ�Ӧ���������Ժ������Ե�˫�����ã����������Ե���������ʵ���Ϊ0��08mol
D. �õ��Ľ�����������ij���Ϊ3��12��
���𰸡�B
�����������������A���ܶ�Ϊ1.40g/cm3����������Ϊ63%��Ũ��������ʵ���Ũ��=![]() mol/L =14mol/L����A��ȷ��B������������1.0mol/L NaOH��Һ��ǡʹ��Һ�еĽ�������ȫ����������ʱ��Һ������ΪNaNO3����NԪ���غ��֪n��NaNO3��+n��NO2��=n��HNO3������n��NaNO3��=0.05L��14mol/L-
mol/L =14mol/L����A��ȷ��B������������1.0mol/L NaOH��Һ��ǡʹ��Һ�еĽ�������ȫ����������ʱ��Һ������ΪNaNO3����NԪ���غ��֪n��NaNO3��+n��NO2��=n��HNO3������n��NaNO3��=0.05L��14mol/L-![]() =0.62mol�����������غ�n��NaOH��=n��NaNO3��=0.62mol������Ҫ1.0mol/L NaOH��Һ���Ϊ
=0.62mol�����������غ�n��NaOH��=n��NaNO3��=0.62mol������Ҫ1.0mol/L NaOH��Һ���Ϊ![]() =0.62L=620mL����B����C���������Ե���������NO2���壬����Nԭ���غ��֪��������������������ʵ���=
=0.62L=620mL����B����C���������Ե���������NO2���壬����Nԭ���غ��֪��������������������ʵ���=![]() =0.08mol����C��ȷ��D���ɵ���غ��֪�����������������������ʵ�������ת�Ƶ������ʵ������������������ʵ���Ϊ0.08mol����5-4��=0.08mol����������������=1.76g+0.08mol��17g/mol=3.12g����D��ȷ����ѡB��
=0.08mol����C��ȷ��D���ɵ���غ��֪�����������������������ʵ�������ת�Ƶ������ʵ������������������ʵ���Ϊ0.08mol����5-4��=0.08mol����������������=1.76g+0.08mol��17g/mol=3.12g����D��ȷ����ѡB��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵����ȷ����( )
A��Na2O2��ˮ��Ӧʱ��1 mol Na2O2ת��1 mol����
B��78gNa2O2��������������������4NA
C��1mo1L��1��AlC13��Һ�У�C1�����ӵ���ĿΪ3 NA
D��5.6 g�����������ᷴӦת�Ƶĵ�����Ϊ0.3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ȼ�������ɿ�����CO2��NaOH��Ӧ��IJ�������ɡ���ȡ��Ȼ����Ʒ3.32g������ˮ����������ᣬ�������CO2�����Ϊ672 mL����״��������ȡ��Ȼ��3.32g���þƾ��Ƽ��ȷֽ�����ȫ������CO2112 mL����״������ˮ0.45g��ͨ������ȷ����Ȼ��Ļ�ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʣ���������ŨH2SO4�����ռ���Һ����Na2CO3���壻�������ƣ���ŨHNO3��������һ������������SiO2��Ӧ����(����)
A. �٢ڢ� B. �ڢۢ� C. �٢ۢܢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������п��a��b���ֱ���������ϡ�����У�a��ͬʱ��������CuSO4��Һ�����и�ͼ�б�ʾ����������������V����ʱ�䣨t���Ĺ�ϵ��ȷ���ǣ� ��
A��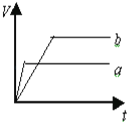 B��
B��
C�� D��
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʾ������Ԫ���У�W��X��Y��ZΪ������Ԫ�أ�������Ԫ�ص�ԭ������������֮��Ϊ22������˵����ȷ����

A. X��Y��Z����Ԫ����ͼ��⻯��ķе���������
B. ��X��Y��������Ԫ���γɵĻ�������ֻ�й��ۼ�
C. ����WY2��W3X4��WZ4�����۵�ߡ�Ӳ�ȴ������
D. TԪ�صĵ��ʾ��а뵼������ԣ�T��ZԪ�ؿ��γɻ�����TZ4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ��ʵľ����У�һ�������ڵ�������
A. ԭ��B. ����C. ������D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ����
A. ����MgCl2��6H2O�ɵõ���ˮMgCl2
B. ��Һ��c��H+��>c��OH����������Һһ��������
C. ��ˮ�м��������Ҳ���ܻ�����ˮ�ĵ���
D. Mg(HCO3)2��Һ���ɵõ��Ĺ���������Mg(OH)2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com