
【题目】下表是元素周期表的一部分,所列字母分别代表一种元素:
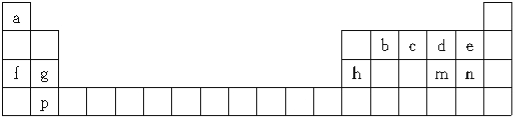
(1)m元素在周期表中的位置是 。
(2)下列有关说法正确的是 (填字母)。
A.b、c、d元素的非金属性逐渐增大 |
B.f、g、h元素的原子半径逐渐减小 |
C.md2与bd2的化学性质类似,都具有氧化性 |
D.e、n的最高价含氧酸的酸性强弱:e>n |
E.a、f分别与d组成的化合物中所含化学键类型完全相同
F.该表中只有4种元素组成的单质具有导电性
(3)a、c、n按原子个数比为4:1:1构成的化合物是 。
【答案】(1) 第三周期ⅥA族 (2) ABC (3)NH4Cl
【解析】试题分析:根据元素在周期表中的相对位置可判断a是H,b是C,c是N,d是O,e是F,f是Na,g是Mg,h是Al,m是S,n是Cl,p是Ca。
(1)硫的原子序数是16,在周期表中的位置是第三周期ⅥA族;
(2)A、同周期自左向右非金属性逐渐正确,则b、c、d元素的非金属性逐渐增大,A正确;B、同周期自左向右原子半径逐渐减小,则f、g、h元素的原子半径逐渐减小,B正确;C、二氧化硫和二氧化碳均是酸性氧化物,性质相似,C正确;D、F没有含氧酸,D错误;E、H、Na与O形成的化合物是水、双氧水、氧化钠、过氧化钠,水和双氧水中含有共价键,氧化钠和过氧化钠中含有离子键,其中过氧化钠中还含有共价键,E错误;F、具有导电性的有Na、Mg、Al、Ca以及石墨,共计5种,F错误,答案选BAC。
(3)a、c、n按原子个数比为4:1:1构成的化合物是NH4Cl。


科目:高中化学 来源: 题型:
【题目】世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
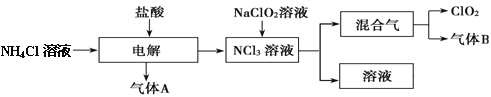
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.四氯化碳
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为 。
缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 。此法提高了生产及储存、运输的安全性,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组粒子互为同位素的是 (填编号,下同)。互为同素异形体的是 ,互为同分异构体的是 互为同系物的是 。
①16O2和18O3
②质子数相同而中子数不同的两种粒子
③11H、D、T
④3015R和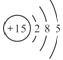 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖
⑥
⑦CH3CH2CH2CH2CH2CH3和(CH3)2CHCH(CH3)2
⑧(CH3)2CHCH(CH3)2和C(CH3)4
(2)生活中的一些问题常涉及化学知识,下列叙述正确的是(填序号) 。
①淀粉、蛋白质都是天然有机高分子化合物
②食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
③禁止使用含铅汽油是为了提高汽油的燃烧效率
④福尔马林是一种良好的杀毒剂,也可用来消毒自来水
⑤随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
⑥向蛋白质溶液中加入(NH4)2SO4浓溶液,蛋白质会析出,加水后不再溶解
⑦为保证加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
(3)在实验室生成乙酸乙酯的可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) .
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2![]() Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。
Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。

(1)上述反应中的还原剂是__________,其还原产物是________。
(2)该反应________(填“吸热”或“放热”),反应热ΔH________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用惰性电极电解K2MnO4水溶液的方法来生产KMnO4,请写出阳极的电极反应式 ,电解总反应的化学方程式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是_________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 制得硫酸锰晶体。(MnSO4H2O,相对分子质量为169)
a.过滤 b.蒸发浓缩 c.冷却结晶 d.灼烧
(7)已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍。
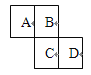
(1)写出A、B、C、D的元素符号:A 、B 、
C 、D 。
(2)A、B、C、D的气态氢化物最不稳定的是(写化学式) 。
(3)A、D两元素的气态氢化物相互反应的化学方程式为 ,现象为 ,产物为 化合物(填“离子”或“共价”)。该化合物中存在的化学键有 (填“离子键”或“共价键”)。
(4)写出下列电子式:
D的气态氢化物 ,A单质 。B的气态氢化物的形成过程用电子式表示: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___________(填“酸性”、“中性”或“碱性”或“酸碱性无法确定”),理由是___________。
(2)某温度下,向0.1mol/L的NaHB溶液中滴入0.1mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母).
A.c(H+)c(OH-)═1×10-14 mol2/L2
B.c(Na+)+c(K+)═c(HB-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)═0.05mol/L
(3)已知常温下H2B的钙盐(CaB)饱和溶液中存在以下平衡:CaB(s) ![]() Ca2+(aq)+B2-(aq)△H>0.
Ca2+(aq)+B2-(aq)△H>0.
①温度升高时,Ksp ___________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)___________,原因是___________(用文字和离子方程式说明)。
(4) 已知0.1molL-1NaHB溶液的pH=2,则0.1molL-1H2B溶液中氢离子的物质的量浓度可能是___________0.11molL-1(填“<”、“>”、或“=”); 理由是___________。
(5)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 ,该反应为 反应(填“放热”或“吸热”)。
(2)t1=________s, 完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是__________。
(4)t1______(填“>”或“<”)t4,原因是________________________________。
t2________t3(填“>”或“<”),原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
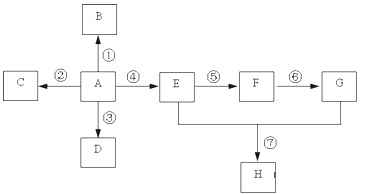
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:反应① ___________,反应②___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com