
| A. | NaHCO3 溶液的pH=8,则溶液中:c(CO32-)>c(H2CO3) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 10 mL pH=12 的氢氧化钠溶液中加入pH=2 的HA 溶液至pH 恰好等于7,所得溶液的总体积一定等于20 mL | |
| D. | 浓度相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,c(NH4+)大小顺序为②>③>① |
分析 A.根据NaHCO3溶液的中HCO3-的水解程度大于自身的电离程度来回答;
B.溶液中存在物料守恒,n(Na)=2n(C);
C.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL;
D.等浓度的②(NH4)2SO4溶液、①NH4Cl溶液中铵根离子浓度②>①,③NH4HSO4溶液中电离出的氢离子抑制铵根离子水解,据此判断;
解答 解:A.因NaHCO3溶液显碱性,HCO3-的水解程度大于自身的电离程度,即NaHCO3溶液中既存在电离平衡为HCO3-?CO32-+H+,水解平衡为HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度,c(CO32-)<c(H2CO3),故A错误;
B.Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C.如果HA是强酸,当溶液的pH=7,HA体积为10mL,如果HA是弱酸,当溶液的pH=7时,HA体积小于10mL,所以所得溶液的总体积V≤20ml,故C错误;
D.同温下,等浓度的①NH4Cl溶液、②(NH4)2SO4溶液、③NH4HSO4溶液,①NH4Cl溶液、②(NH4)2SO4溶液中铵根离子浓度①<②,③NH4HSO4溶液中电离出的氢离子抑制铵根离子水解,溶液中铵根离子浓度③>①,则溶液中铵根离子浓度大小为②>③>①,故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 合金一定是由两种或多种金属熔合而成的 | |
| B. | 日常生活中用到的五角硬币属于铜合金 | |
| C. | 铝合金的硬度比铝的大,熔点比铝的高 | |
| D. | 商代的司母戊鼎是由纯铜打造而成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
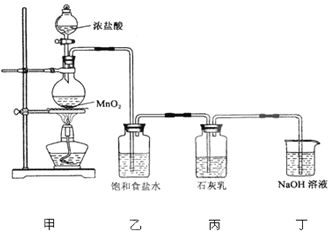
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,由A生成F的反应类型是加聚反应.
,由A生成F的反应类型是加聚反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
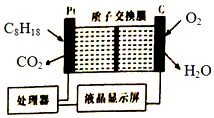
| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式:C8H18+16H2O-50e-═8CO2↑+50H+ | |
| C. | H+由质子交换膜左侧向右侧迁移 | |
| D. | 每消耗5.6LO2,电路中通过1 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 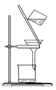 装置可用于提纯胶体 | |
| B. | 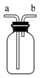 装置可用于排空气法收集气体,可收集CO2、NH3、H2等 | |
| C. |  装置可用于吸收SO2 | |
| D. |  装置可用验证浓硫酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )
锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )| A. | 氧气在石墨电极上发生氧化反应 | |
| B. | 该电池的负极反应为Zn+H2O-2e-=ZnO+2H+ | |
| C. | 该电池放电时OH-向石墨电极移动 | |
| D. | 该电池充电时应将Zn电极与电源负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeC13溶液中:A13+、NH4+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、K+、SO42-、NO3- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-15mol/L的溶液中:Na+、Fe3+、I-、AlO2- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K +、.MnO 4 -、Cl -、SO 4 2- | B. | Na +、CO 3 2-、Cl -、SO 4 2- | ||
| C. | NO 3 -、Na +、HCO 3 -、Ba 2+ | D. | Na +、NO 3 -、NH 4 +、SO 4 2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com