
| A. | 验证某有机物属于烃,完成的实验只要证明它完全燃烧后的产物只有H2O和CO2 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 黄酒中存在的某些微生物可以使部分乙醇氧化,转化为乙酸,酒就有了酸味 | |
| D. | 乙烯使酸性高锰酸钾溶液,溴的四氯化碳溶液褪色,由于乙烯发生了加成反应 |
分析 A.烃及烃的含氧衍生物燃烧生成水和二氧化碳;
B.苯具有芳香气味;
C.乙醇可被氧化生成乙酸;
D.乙烯与高锰酸钾发生氧化反应.
解答 解:A.烃及烃的含氧衍生物燃烧生成水和二氧化碳,则完全燃烧后的产物只有H2O和CO2,不一定为烃,故A错误;
B.苯具有芳香气味,为液体烃,故B错误;
C.乙醇可被氧化生成乙酸,则黄酒中存在的某些微生物可以使部分乙醇氧化,转化为乙酸,酒就有了酸味,故C正确;
D.乙烯与高锰酸钾发生氧化反应,而溴的四氯化碳溶液褪色,乙烯发生了加成反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: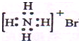 | |
| B. | S2-的结构示意图: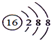 | |
| C. | 乙酸的分子式:CH3COOH | |
| D. | 原子核内有18个中子的氯原子:37Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M元素位于周期表中的第三周期第VIA族 | |
| B. | Z元素是硅,其在自然界中存在游离态 | |
| C. | X与M的单质在高温下反应得到的二元化合物分子中,存在极性共价键 | |
| D. | 四种元素中的Y单质可用于航空航天合金材料的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
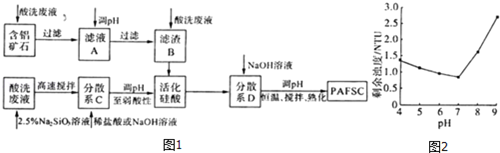
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com