
【题目】根据反应2Ag+Cl2=2AgCl设计的一种原电池的装置如图。下列说法正确的是
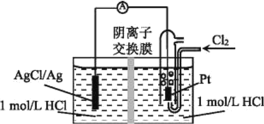
A.负极反应为Cl2+2e-=2Cl-
B.放电时,离子交换膜右侧溶液中有白色沉淀生成
C.理论上,可以用NaCl溶液代替盐酸
D.当电路中有0.01 mole-转移时,交换膜左侧溶液中约减少0.02 mol离子
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( )
A.SnO2·4H2OB.Sn(NO3)4
C.Sn(NO3)2D.Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在含有AlO2—溶液中通入足量CO2 ,写出反应的离子方程式____________
(2)Al2O3在碳的还原作用下生成铝的气态低价氧化物X (X中Al与O的质量比为6.75∶2)则X的化学式为_________。
(3)三氟化氮(NF3)是一种无色、无臭的气体。三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,反应产物中生成酸M、酸N和一种无色气体(遇空气变成红棕色),其中酸M是一种弱酸,酸N为常见的含氧强酸。
① 写出该反应的化学方程式_________。
② 酸M是弱酸(难电离)的原因是____________
③一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO3、NaF等盐外,还可以生成的盐是____________(填化学式)。
④在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。写出a电极的电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿斯巴甜(Aspartame,结构简式如图)具有清爽的甜味,甜度约为蔗糖的200倍.下列关于阿斯巴甜的错误说法是
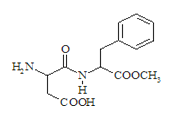
A.在一定条件下能发生取代反应、加成反应
B.酸性条件下的水解产物中有两种氨基酸
C.一定条件下既能与酸反应、又能与碱反应
D.分子式为C14H18N2O3,属于蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) +yB(g)![]() z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y < zB.平衡向正反应方向移动
C.C的体积分数下降D.B的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。X可分别与Y、W 形成X2Y、X2Y2、XW等共价化合物;Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
(1)Z2Y2的电子式为________。
(2)写出化合物ZX与稀硫酸反应的离子方程式_______。
(3)常温下,实验测得0.lmol/L的X2Y2的水溶液的pH=5.4,则X2Y2在水中的电离方程式为_______。
II.利用电解饱和ZW溶液及CuCl 溶液合成1, 2—二氯乙烷的实验装置如图所示。

(4)离子交换膜X为_________(选填“阴”或“阳”)离子交换膜;该装置总反应的化学方程式为_______。
(5)要生成1 mol ClCH2CH2Cl,则释放出的H2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:HCO3-+H2O![]() H2CO3+OH- Kh=2.2×10-8
H2CO3+OH- Kh=2.2×10-8
NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
将NH4HCO3溶液和氨水按一定比例混合,可用于浸取矿渣中ZnO。若溶液混合引起的体积变化可忽略。
(1) 0.2 mol·L-1氨水中,c(NH4+)、c(OH-)、c(NH3·H2O)、c(H+)按从大到小的顺序排列为________;常温下,0.2 mol·L-1NH4HCO3溶液 pH________7 (选填“>”、“〈”或“=”)。
(2) 0. 2 mol·L-1 氨水和 0. 2 mol·L-1 NH4HCO3 溶液等体积混合后(NH3 按 NH3·H2O算),c(NH4+)+c(NH3·H2O)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产氯化铜晶体的流程如下:

(1)反应Ⅰ中所加Zn粉不能过量的原因是______________________
(2)滤液Ⅱ中含有的主要金属阳离子是___________________
(3)写出反应Ⅱ的化学方程式____________________________________________________
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、__________、___________。
(5)在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是___________________________________________________(用化学方程式表示)
(6)CuCl2·xH2O晶体中x值的测定:称取3.420g产品溶解于适量水中,向其中加入含AgNO3 4.400×10-2mol的AgNO3溶液(溶液中除Cl- 外,不含其它与Ag+反应的离子),待Cl- 完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的KSCN标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定终点的现象是_______________________________________。
②若滴定过程用去上述浓度的KSCN标准溶液20.00mL,则CuCl2·xH2O中x值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com