
【题目】随着碱金属元素原子序数的增大,下列递变规律错误的是( )
A.原子半径逐渐增大
B.最高价氧化物对应水化物的碱性逐渐增强
C.单质的熔、沸点逐渐升高
D.单质的还原性逐渐增强
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到过量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中错误的是
A. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100ml
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C. 参加反应的金属的总质量为9.6g>m>3.6g
D. 当金属全部溶解时收集到NO气体的体积在标准状况下一定为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.用pH试纸测定NaClO溶液的pH
B.电解饱和MgCl2溶液制取金属镁
C.用酸式滴定管量取20.00mL KMnO4溶液
D.滴定前用待测液润洗锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.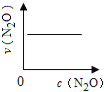 B.
B.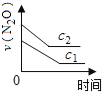 C.
C.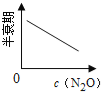 D.
D.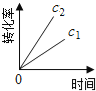
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
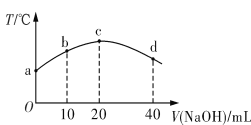
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,其中W为无机非金属材料的主角,下列说法正确的是
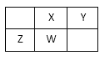
A. W位于第三周期Ⅳ族
B. Y的气态氢化物分子中含极性共价键
C. X的最高价氧化物的电子式是![]()
D. 常温下不能用Z单质制成的容器盛放Y的最高价氧化物对应的水化物的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,分别与周期数、主族序数相同的一组是()
①质子数 ②核电荷数 ③电子层数 ④原子序数 ⑤最外层电子数
A.③⑤B.②③C.③④D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com