
【题目】下列除杂质的方法可行的是( )
A. 加入新制的生石灰,然后加热蒸馏,可以除去乙醇中少量的水
B. 通过装有酸性高锰酸钾溶液的洗气瓶,可以除去甲烷中的乙烯
C. 用苯通过分液的方法,可以除去溴苯中的溴
D. 用氢氧化钠溶液,通过分液的方法,可以除去乙酸乙酯中的乙酸
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.石油分馏时温度计水银球位置处在蒸馏烧瓶的支管口附近
B.在葡萄糖溶液中加入硫酸铜溶液,加热,可观察到砖红色沉淀
C.在乙醇中加入钠可产生氢气
D.浓HNO3应保存在棕色试剂瓶中,并贮存在避光、低温处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A.常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO﹣)>c(Na+)
B.1 molL﹣1的硫化钠溶液中,c(H+)+c(Na+)=c(OH﹣)+c(HS﹣)+c(S2﹣)
C.稀释醋酸溶液,溶液中所有离子的浓度均降低
D.pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g),下列速率关系中,正确的是( )
A. 4v(NH3)=5v(O2)B. 5 v(O2)=4v(NO)
C. 5v(O2)=6v(H2O)D. 3v(NO)=2v(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol锌粒与足量盐酸反应产生11.2 L H2
B.标准状况下,11.2 L CCl4所含分子数为0.5NA
C.0.1 mol CH4所含氢原子数为0.4NA
D.常温常压下,28 g N2中所含原子个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: 一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g)CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是(填序号).
A.每消耗1mol CO的同时生成2molH2B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)K(B)(填“>”、“=”或“<”).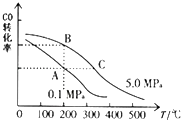
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= , 此温度下的平衡常数K=(保留两位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
(1)Cu2+基态的电子排布式可表示为;
(2)SO42﹣的空间构型为(用文字描述);中心原子采用的轨道杂化方式是;写出一种与SO42﹣互为等电子体的分子的化学式:;
(3)向CuSO4 溶液中加入过量NaOH溶液可生成[Cu (OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 .
(5)CuS比CuO的熔点(填高或低),原因是 .
(6)闪锌矿的主要成分ZnS,晶体结构如图所示,其晶胞边长为540.0pm,密度为(列式并计算),a位置S2﹣离子与b位置Zn2+离化学﹣选修5:有机化学基础子之间的距离为pm(列式表示). 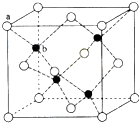
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质的比较中正确的是
A. 酸性:HClO4<H2SO4<H3PO4 B. 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
C. 稳定性:HF>HCl>PH3>H2S D. 原子半径:O>S>Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( ) 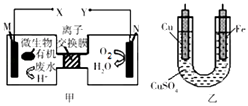
A.M电极反应式:(C6H10O5)n+7nH2O﹣24ne﹣═6nCO2↑+24nH+
B.铜电极应与X相连接
C.质子透过离子交换膜由右向左移动
D.当N电极消耗0.2 mol气体时,则铁电极增重16g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com